Błędne ognie - barwne płomienie
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (1/2020):

Tajemnicze zjawisko
Odkrywanie i poznawanie praw rządzących naszym światem jest dla naukowca - a także, w mniej lub bardziej świadomy sposób dla każdego - czymś bardzo ważnym, wręcz treścią życia. powinno być: Z tego powodu można według mnie utożsamić piękno rzeczywistości z jej tajemniczością. Dzięki temu możemy wątpić, poszukiwać, badać i doświadczać nowych zjawisk. W tym aspekcie uświadomienie sobie tego, jak mało wiemy (a więc jak dużo możemy się jeszcze dowiedzieć) może być połączone z pozytywnymi przeżyciami natury duchowej i emocjonalnej, ale także daje powód by angażować się w naukę.
Jednym z ciągle nieco tajemniczych zjawisk jest powstawanie tak zwanych błędnych ogni, które zyskało potencjał mitotwórczy.
Błędne ognie to zjawisko znane badaczom folkloru na całym świecie. Fenomen ten występuje pod wieloma lokalnymi nazwami: japońskie Onibi, anglosaski will-o'-the-wisp i węgierski Lidérc to tylko niektóre z manifestacji tego fenomenu. Najprawdopodobniej właśnie takie zjawisko w swojej autobiografii opisał sam Goethe:
Naraz, w zagłębieniu terenu na prawo od drogi zauważyłem coś jakby pięknie oświetlony amfiteatr. W przestrzeni o kształcie lejka można było zobaczyć nieprzeliczone mrowie małych światełek migocących i falujących, a świeciły tak jasno, że raziły oko. Widok komplikowało dodatkowo to, że nie pozostawały one w jednym miejscu, ale skakały to tu, to tam, z góry na dół i odwrotnie, w każdym kierunku. Większa ich część jednakże pozostawała w miejscu, migocąc tylko. Jedynie z najwyższą niechęcią dałem się oderwać od tego spektaklu, któremu chciałem się przyjrzeć dokładniej.
Błędne ognie według podań najczęściej miały się pojawiać w nocy, jako odległe światełka migoczące tuż nad powierzchnią gruntu. Najczęściej występowały na obszarach bagiennych, nad wodą lub w górach. Miały zwodzić wędrujących nocą ludzi. Słowianie wierzyli, że ognikami stawały się po śmierci dusze ludzi okrutnych, obojętnych na krzywdę ludzką, złych i nieuczciwych. Poprzez zwodzenie ludzi odpokutowywały one za krzywdy wyrządzone innym za życia [1] [2].
Dzisiaj zjawisko powstawania ogników na bagnach tłumaczy się występowaniem samozapłonu fosforowodoru PH3 (w mieszaninie z pewnymi palnymi gazami, np. metanem CH4) lub innych gazów powstających przy rozkładzie materiałów organicznych [3].
Prawdziwe błędne ognie - oczywiście jeśli naprawdę istnieją - pozostawmy folklorystom i innym naukowcom. Jako eksperymentatorzy stwórzmy w laboratorium swoje własne błędne ogniki, które mimo innego mechanizmu powstawania będą napawały nasze oczy pięknem, a jednocześnie pozwolą zachęcić innych do nauki tej wspaniałej dziedziny, jaką jest chemia.
Potrzebne substancje
Do przeprowadzenia doświadczenia potrzebujemy substancji z poniższej listy:
- kwas chlorowodorowy HClaq (stężony),
- chlorek miedzi CuCl2,
- glin Al (folia aluminiowa).
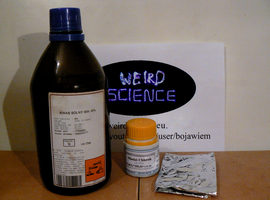
Szczęśliwie dla nas, wszystkie materiały są stosunkowo łatwo dostępne (Fot.1).
Kwas chlorowodorowy, nazywany inaczej solnym, jest silnie żrący i może wywołać ciężkie poparzenia skóry. Ulatniający się z niego gazowy chlorowodór HCl ma działanie drażniące, a w większych stężeniach jest trujący.
Dihydrat chlorku miedzi(II) CuCl2•2H2O ma postać szmaragdowozielonych kryształów (Fot.2). W tej formie występuje jako rzadki minerał eriochalcyt [4]. Otrzymać go można poprzez roztworzenie węglanu miedzi(II) CuCO3 w kwasie chlorowodorowym.
Chlorek miedzi(II), podobnie jak inne sole metali ciężkich, może wykazywać działanie szkodliwe i rakotwórcze. W doświadczeniu można wykorzystać także inne związki miedzi, ale chlorek zapewnia lepsze wyniki niż większość z nich.
Ostatnią potrzebną substancją jest glin w formie tzw. spożywczej folii aluminiowej. Trzeba uformować z niej niewielkie, dosyć mocno ugniecione kulki o średnicy około 0,5cm – rozmiar trzeba dobrać doświadczalnie, ponieważ efekt w pewnym stopniu zależy od tego parametru (Fot.3).
Posiadając już wszystkie potrzebne substancje, możemy przystąpić do właściwego pokazu.
Pokaz!
Przystępując do pokazu, musimy do stosunkowo dużej zlewki wlać ostrożnie kilkanaście centymetrów sześciennych stężonego kwasu solnego, po czym rozpuścić w nim kilka niewielkich kryształów chlorku miedzi. Uzyskany w ten sposób roztwór ma intensywnie zielony kolor. Zlewkę należy umieścić w większym naczyniu z wodą (Fot.4). Powinien być to na przykład krystalizator lub większa zlewka – szalka Petriego pozuje jedynie do zdjęcia dla większej przejrzystości.
Łaźnia wodna ma na celu chłodzenie układu reakcyjnego, ponieważ reakcja jest silnie egzotermiczna.
Doświadczenie jest szalenie efektowne, ale może także być niebezpieczne. Bardzo ważne jest aby stosować odpowiednie środki bezpieczeństwa. Absolutnie koniecznie trzeba używać okularów ochronnych (Fot.5). Między układem reakcyjnym a widownią powinna się znaleźć przejrzysta przegroda, wykonana najlepiej z odpowiedniego tworzywa sztucznego. Prezentujący doświadczenie eksperymentator musi oczywiście używać także pozostałych podstawowych środków ochrony osobistej, tj. rękawic i fartucha.
Chcąc uruchomić reakcję, do roztworu wrzucamy jedną lub dwie kulki z folii aluminiowej. Po chwili zauważamy wyraźny efekt; glin ulega roztworzeniu, roztwór się silnie rozgrzewa i pieni. Ostrożnie zapalamy powstający gaz. Dochodzi do zapłonu, a nad roztworem powstają nieregularne, ciągle poruszające się płomienie o pięknej, niebieskiej barwie (Fot.6).
Doświadczenie można powtarzać kilkukrotnie, uzupełniając roztwarzany glin. Jednocześnie nie należy jednak wrzucać więcej niż jednej czy dwóch kulek z folii.
Wyjaśnienie
Podczas reakcji glinu z kwasem solnym uwalniają się duże ilości gazowego wodoru w myśl równania reakcji:
Po zapaleniu wodór spala się w tlenie atmosferycznym. Związki miedzi takie jak CuCl22 w podwyższonej temperaturze płomienia stosunkowo łatwo dysocjują – w tych warunkach miedź odpowiada za charakterystyczny niebiesko-zielony kolor płomienia. Lekka kulka aluminiowa w czasie reakcji gwałtownie miota się po powierzchni roztworu napędzana uwalniającym się gazem, dzięki czemu płomienie mają nieprzewidywalny kształt.
Wiemy, że także inne metale barwią płomień na charakterystyczne kolory, np. sód Na na żółto, wapń Ca na ceglastoczerwony, Bar Ba na jasnozielony itd. Dlatego możemy wytworzyć ogniki także o innych barwach. Fot. 7 przedstawia doświadczenie, w którym sól miedzi zastąpiono chlorkiem rubidu RbCl. W ten sposób możemy uzyskać ogniki fioletowo-różowe.
Istnieje niewielkie prawdopodobieństwo, że w czasie pokazu zostanie wytworzona mieszanina piorunująca, tj. mieszanina gazowego wodoru i tlenu w takim samym stosunku jak w cząsteczce wody. Jest ona silnie wybuchowa i w takim przypadku naczynie reakcyjne może zostać rozerwane eksplozją, a żrąca mieszanina kwasu rozrzucona wokół. Należy brać to niebezpieczeństwo zawsze pod uwagę.
Doświadczenie w bardzo atrakcyjny sposób przybliża tematy związane z tak zwaną analizą płomieniową [5].
Literatura:
- [1] Podgórska B., Podgórski A., Wielka księga demonów polskich, Wydawnictwo KOS, Katowice, 2005 powrót
- [2] Ogrodowska B., Zwyczaje, obrzędy i tradycje w Polsce, Wydawnictwo Verbinum, Warszawa, 2001 powrót
- [3] Fluck E., The chemistry of phosphine, w: Inorganic Chemistry, t. 35/1, Springer-Verlag, Berlin/Heidelberg, 1973, str. 1-64 powrót
- [4] Eriochalcite, w serwisie: https://www.mindat.org/, dostępne online: https://www.mindat.org/min-1398.html [dostęp: 28.12.2020] powrót
- [5] Sanger M. J., Phelps A. J., Banks C., Simple Flame Test Techniques Using Cotton Swabs, Journal of Chemical Education 81 (7), 2004, str. 969 powrót
Wszystkie fotografie i rysunki zostały wykonane przez autora
Marek Ples