Chemiczne rośliny
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (5/2015):

Nieorganiczne błony półprzepuszczalne
Wśród bardzo wielu doświadczeń chemicznych można wyróżnić pewną ilość takich, które mimo tego, że nie posiadają praktycznego zastosowania, to jednak są przydatne z innych powodów. Mogą na przykład ukazywać w wyjątkowo przejrzysty sposób skomplikowane zależności lub olśniewać wspaniałym efektem wizualnym. Do takich właśnie doświadczeń należą chemiczne ogrody, po raz pierwszy opisane już w 1646 roku przez niemieckiego aptekarza i alchemika Johanna Rudolfa Glaubera [1].
Muszę przyznać, że darzę to doświadczenie wielkim sentymentem: było ono jednym z pierwszych, jakie przeprowadziłem w swoim życiu. Myślę, że było ono też jednym z powodów, dla których zainteresowałem się głębiej tą piękną dziedziną wiedzy, jaką jest chemia.
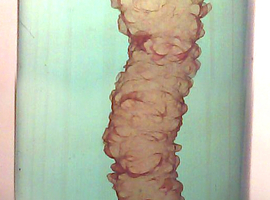
Oryginalne doświadczenie polega na dodaniu kryształów soli niektórych metali przejściowych do roztworu krzemianu sodu Na2SiO3 lub potasu K2SiO3 zwanego powszechnie szkłem wodnym. Efektem jest spontaniczne powstawanie kolorowych wykwitów o formie przywodzącej na myśl rosnące rośliny. Wykorzystanie soli różnych metali, takich jak na przykład żelazo Fe, miedź Cu, nikiel Ni, kobalt Co i innych, zapewnia spektakularny efekt różnokolorowych „roślin” o fantazyjnych kształtach, składających się na piękne „ogrody” (Fot.1) [2] [3].
Ta wersja doświadczenia jest powszechnie znana – jest wspominana nawet w dziełach literatury pięknej [4].
Znacznie mniej znany jest fakt, że podobne chemiczne ogrody można też wyhodować całkowicie rezygnując z wykorzystania krzemianów. Właśnie to chciałbym zaproponować szanownemu Czytelnikowi.
Doświadczenie
By wykonać doświadczenie potrzebujemy jedynie dwóch substancji. Są to:
- siarczan(VI) miedzi(II) CuSO4,
- heksacyjanożelazian(II) potasu K4[Fe(CN)6]·3H2O.
Bezwodny siarczan(VI) miedzi(II) jest silnie higroskopijną substancją barwy białej. Uwodniony, w postaci pentahydratu CuSO4·5H2O jest niebieski (Fot.2). W postaci krystalicznej sól ta bywa nazywana witriolem miedzi lub sinym kamieniem. W naturze występuje w sąsiedztwie pokładów rud miedzi jako minerał chalkantyt.
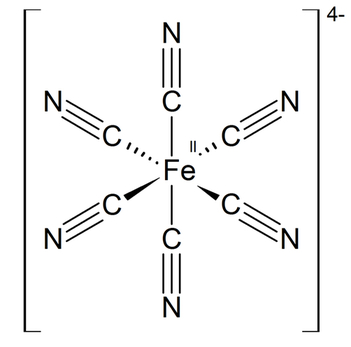
Heksacyjanożelazian(II) potasu K4[Fe(CN)6]·3H2O, nazywany też żelazocyjankiem potasu lub żółtą solą Gmelina należy do grupy cyjanożelazianów(II). Są to sole kompleksowe, w których atomem centralnym jest żelazo na II stopniu utlenienia, a ligandami 6 anionów cyjankowych (Rys.1).
Sól ta formuje żółte kryształy (Fot.3). Z racji dużej trwałości kompleksu związek ten jest uznawany za nietoksyczny. Trzeba jednak pamiętać, że w jego reakcji z mocnymi kwasami dochodzi do uwalniania silnie toksycznego cyjanowodoru HCN w myśl równania reakcji (na przykładzie rozcieńczonego kwasu siarkowego(VI) H2SO4):
Z tego powodu trzeba unikać jakiegokolwiek kontaktu heksacyjanożelazianu(II) z kwasami!
Należy zaznaczyć, że w doświadczeniu używamy właśnie heksacyjanożelazianu(II) potasu K4[Fe(CN)6]·3H2O, a nie podobnego związku, jakim jest heksacyjanożelazian(III) potasu K3[Fe(CN)6]. Łatwo je jednak odróżnić od siebie, ponieważ ten ostatni formuje czerwone kryształy.
Przygotowanie doświadczenia nie jest trudne: trzeba sporządzić jedynie roztwór siarczanu(VI) miedzi(II) w wodzie. Jego stężenie powinno wynosić około 5% [5]. I to już wszystko. Teraz do roztworu wystarczy wrzucić jeden lub kilka niewielkich kryształów heksacyjanożelazianu(II) potasu, co można zobaczyć na Fot.4A.
Już po chwili można zauważyć interesujące zjawisko: kryształy ciemnieją i jakby pęcznieją. Po chwili zaczynają się wokół nich formować brunatne struktury przypominające pnące się do góry kiełki roślin (Fot.4B). Twory te rosną z prędkością zauważalną gołym okiem. Po kilku minutach powstają obiekty kojarzące się z racji swego wyglądu ze strukturami biologicznymi: przypominają one fantazyjne grzyby lub rośliny (Fot.4C i D). Warto zauważyć, że ich wzrost nie jest równomierny, lecz odbywa się skokowo. Dla ciekawszego efektu wizualnego naczynie można podświetlić od spodu.
Powstające struktury są bardzo delikatne, dlatego podczas doświadczenia należy w miarę możliwości wyeliminować wstrząsy naczynia reakcyjnego.
Po pewnym czasie wzrost „roślin” ulega wyraźnemu spowolnieniu, a w końcu ustaje. Dojrzałe struktury wyraźnie ciemnieją. Całe doświadczenie trwa zwykle do kilkunastu minut, jednak ma na to wpływ na przykład temperatura roztworu – jego podgrzanie powoduje pewne przyspieszenie procesu. Efekt finalny przedstawia Fot.5.
Dla dokładniejszego prześledzenia procesu wzrostu opisywanych struktur można zastosować nieco inną procedurę, tj. wykorzystać tylko jeden kryształ heksacyjanożelazianu(II), a reakcję prowadzić w probówce lub zatopionej na końcu rurce szklanej o niewielkiej (<10mm) średnicy.
Dzięki wykorzystaniu wąskiego naczynia łatwiej obserwować wzrost struktury przy wykorzystaniu choćby szkła powiększającego. Chcąc prowadzić obserwacje przy większych wartościach powiększeń można skorzystać z mikroskopu stereoskopowego. Najlepiej nadają się tu mikroskopy starego typu, które można umieścić na dowolnym statywie, np. laboratoryjnym. Jest to przydatne dlatego, że w tym przypadku tubus mikroskopu proponuję umieścić z oczywistych powodów nie pionowo, jak to się robi najczęściej (Fot.7A), lecz poziomo (Fot.7B). Przydają się tu różnego rodzaju łączniki laboratoryjne.
Można też oczywiście zastosować inne rozwiązania. Dobrym pomysłem wydaje się być użycie nowoczesnego mikroskopu cyfrowego produkowanego seryjnie lub wykonanego z wykorzystaniem taniej kamery internetowej [6]. Do uzyskania kolejnych zdjęć wykorzystano właśnie tą ostatnią metodę. Jest ona warta polecenia choćby z tego względu, że umożliwia bezpośrednią obserwację dla większej liczby zainteresowanych, ponieważ obraz może być transmitowany w czasie rzeczywistym na ekran komputera lub za pomocą rzutnika multimedialnego na ekran ścienny.
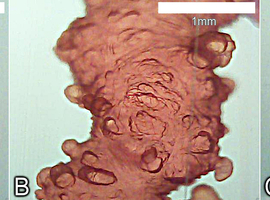
Obserwacje wzrostu struktury najkorzystniej jest prowadzić na dosyć wczesnych stadiach, kiedy odbywa się on z łatwą do zauważenia prędkością (Fot.8).
Można stwierdzić wtedy, że od głównej osi tworu odchodzi wiele bąblowatych wyrostków. Budowa analizowanych struktur jest przy tym raczej jednorodna. Pod tym względem nie znajdujemy tu istotnych różnic między częściami tworu: dolną, środkową i szczytową. Należy zauważyć jednak, że szczyt ma zwykle nieco jaśniejszą barwę niż pozostałe rejony, co widać na Fot.9.
Wyjaśnienie
By wyjaśnić w jaki sposób określone substancje chemiczne formują twory przypominające żywe rośliny musimy przypomnieć sobie o zjawisku osmozy.
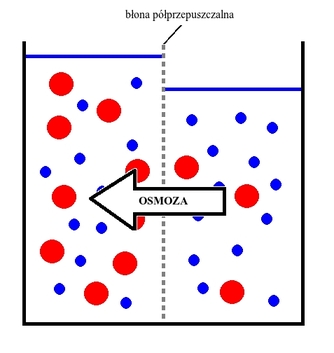
Osmoza ma miejsce wtedy, gdy dwa roztwory o różnym stężeniu rozdzielimy tzw. błoną lub membraną półprzepuszczalną. Błona taka jest przepuszczalna dla cząstek rozpuszczalnika, stanowi jednak przeszkodę dla cząstek substancji rozpuszczonej. Osmoza spontanicznie zachodzi od roztworu o niższym stężeniu do roztworu o wyższym, prowadzi więc do wyrównania stężeń obu roztworów. Efektem tego jest powiększenie się objętości roztworu początkowo bardziej stężonego, zmniejszanie zaś mniej stężonego (Rys.2). Powoduje to powstanie pewnego ciśnienia, nazywanego ciśnienia osmotycznym.
Osmoza ma bezpośredni związek z formowaniem się struktur. Po wrzuceniu kryształu heksacyjanożelazianu(II) potasu dochodzi do jego reakcji z siarczanem(VI) miedzi(II), co prowadzi do powstania brunatnego heksacyjanożelazianu(II) miedzi(II) o wzorze Cu2[Fe(CN)6]. Co ważne, związek ten jest w wodzie praktycznie nierozpuszczalny, więc formuje szczelną warstwę na powierzchni kryształu. Myślę, że Czytelnik już się domyśla, że owa cienka warstwa ma cechy błony półprzepuszczalnej. Wewnątrz powstałego pęcherzyka stężenie rozpuszczonej soli jest dużo większe niż na zewnątrz, więc na skutek osmozy ciśnienie w jego wnętrzu rośnie. Powoduje to wzrost naprężenia błony, rozdęcie powstałego pęcherzyka i w końcu jego pęknięcie. Wtedy część roztworu wylewa się z wnętrza pęcherzyka, dochodzi do kolejnej reakcji i powstania nowego fragmentu błony. Ta sekwencja zdarzeń powtarza się wielokrotnie, dając w końcu formy podobne do roślin. Znajduje to także potwierdzenie w budowie tworów widocznych na Fot.9 – bąblowate wyrostki są pozostałością po pęknięciach błony półprzepuszczalnej.
W ten sam sposób powstają wspomniane na początku krzemianowe ogrody chemiczne, z tym jednak, że tam błonę półprzepuszczalną budują odpowiednie krzemiany metali.
Zauważmy, że w górnej części tworu nowopowstała błona jest cieńsza niż w pozostałych rejonach co objawia się jej jaśniejszą barwą. Z tego powodu pęka ona najłatwiej właśnie w tym punkcie, przez co cały twór ma tendencję do wydłużania się. Dlaczego jednak „rośliny” rosną do góry? Jest to spowodowane ciśnieniem hydrostatycznym i siłą wyporu. Dowiedziono tego w próbach wytworzenia wspomnianych struktur w warunkach mikrograwitacji na Międzynarodowej Stacji Kosmicznej ISS. Przy braku siły wyporu nie dochodziło wtedy do ich wytworzenia, lub powstające wypustki rozrastały się w przypadkowych kierunkach [7].
Myślę, że opisane doświadczenie w interesujący sposób ukazuje zjawisko osmozy, które często wydaje się jednym z trudniej uchwytnych w życiu codziennym fenomenów. Trzeba jednak pamiętać, że pełni ono niebagatelną rolę w tym najciekawszym zjawisku, które nazywamy życiem – wiele błon biologicznych jest przecież właśnie błonami półprzepuszczalnymi [8].
Literatura:
- [1] Glauber J. R., Furni novi philosophici Oder Beschreibung einer New-erfundenen Distilir-Kunst, vol. 2, Amsterdam, 1646 powrót
- [2] Roesky H.W., Möckel K., Niezwykły świat chemii, Wydawnictwo Adamantan, 2001, str. 23-24 powrót
- [3] Sękowski S., Efektowna Chemia, Wydawnictwa Naukowo-Techniczne, Warszawa, 1988, str. 147-150 powrót
- [4] Mann T., Doktor Faustus, rozdz. II, Wydawnictwo Muza, Warszawa, 2008 powrót
- [5] Sękowski S., Efektowna Chemia, Wydawnictwa Naukowo-Techniczne, Warszawa, 1988, str. 150-151 powrót
- [6] Ples M., Nieprzyzwoicie tani mikroskop, Biologia w Szkole, 4 (2015), Forum Media Polska Sp. z o.o., str. 55-60 powrót
- [7] Cartwright J.H.E., Escribano B., Sainz-Díaz C. I., Stodieck L. S., Chemical Garden Formation, Morphology, and Composition. Chemical Gardens in Microgravity, Langmuir, 27(7), 2011, str. 3294-3300 powrót
- [8] Alberts B., Bray D., Johnson A., Lewis J., Raff M., Roberts K., Walter P., Podstawy biologii komórki. Wprowadzenie do biologii molekularnej, Wydawnictwo Naukowe PWN, Warszawa, 1999 powrót
Uzupełnienie autora
Jako dodatek do powyższego tekstu chciałbym zaproponować film prezentujący doświadczenie:
Marek Ples