Enzymy - biologiczne katalizatory
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (3/2016):

Enzymami nazywamy wielkocząsteczkowe, najczęściej białkowe substancje, które pełnią funkcję biologicznych katalizatorów o bardzo specyficznym działaniu. Przyspieszają one różnorodne reakcje, składające się na chemiczny aspekt zjawiska, które nazywamy życiem.
Większość reakcji, w których biorą udział opisywane związki przebiega z prędkością znacznie większą niż reakcje niekatalizowane. Anhydraza węglanowa jako jeden z najszybciej działających enzymów jest w stanie przeprowadzić w ciągu sekundy około 106 reakcji tworzenia jonu wodorowęglanowego HCO3– z dwutlenku węgla CO2 i wody H2O, co oznacza około 107-krotne przyspieszenie procesu w stosunku do reakcji bez udziału katalizatora [1] [2].
Chociaż już wcześniej obserwowano fakt trawienia substancji białkowych przez wydzieliny żołądka poza organizmem żywym [3], to dopiero w XIX i na początku XX wieku prace Luisa Pasteura, Wilhelma Kuhna oraz Eduarda Buchnera wyjaśniły istotę zjawiska. Ten ostatni otrzymał w 1907 roku Nagrodę Nobla za prace nad enzymami pochodzącymi od drożdży [4].
Enzymy w zależności od katalizowanych przez nie reakcji dzieli się na sześć podstawowych klas opatrzonych tzw. numerami EC [5]:
- oksydoreduktazy (EC 1) – utlenianie i redukcja zróżnicowanych substratów,
- transferazy (EC 2) – przenoszenie grup funkcyjnych,
- hydrolazy (EC 3) – hydroliza wiązań różnego rodzaju,
- liazy (EC 4) – przecinanie różnorodnych wiązań w sposób inny niż przez utlenianie lub hydrolizę,
- izomerazy (EC 5) – zmiany izomeryzacyjne cząsteczek,
- ligazy (EC 6) – tworzenie nowych wiązań kowalencyjnych.
Enzymy z punktu widzenia biologii pełnią rolę, której nie sposób przecenić. Dzięki temu, że biorą udział w praktycznie wszystkich prowadzonych w organizmie żywym reakcjach anabolicznych i katabolicznych określają całościowy kształt metabolizmu. Enzymy różnego rodzaju, katalizując określone reakcje niejako kierują więc szlakami metabolicznymi w organizmie.
Wydawać by się mogło, że możliwość pracy z tak specyficznymi substancjami jak enzymy jest zarezerwowana jedynie dla specjalistycznych laboratoriów. Nic bardziej mylnego! Postaram się przekonać Czytelnika, że obecność różnorodnych enzymów w materiale biologicznym można wykryć nawet bardzo nieskomplikowanymi metodami. Myślę, że może to być bardzo pouczające, a jednocześnie satysfakcjonujące dla każdego poszukiwacza wiedzy.
Ureazy
Ureazy są enzymami z klasy hydrolaz katalizującymi hydrolizę mocznika CO(NH2)2 do amoniaku NH3 i dwutlenku węgla CO2.
W centrum aktywnym enzymów z tej grupy w warunkach naturalnych występuje nikiel, ale w laboratoriach udało się osiągnąć aktywność katalityczną przy podmianie tego metalu na mangan oraz kobalt [6]. Masa cząsteczkowa aktywnej formy enzymu wynosi około 500kDa.
Substancja ta występuje w drożdżach, bakteriach (np. Helicobacter pylori), ale też w niektórych roślinach wyższych, np. w kanawalii mieczokształtnej Canavalia ensiformis należącej do rodziny bobowatych Fabaceae. Właśnie z tkanek tej rośliny ureaza została wyizolowana w 1926 roku przez Jamesa B. Sumnera, który stwierdził, że jest ona białkiem [7].
Jako źródło ureazy do naszych doświadczeń dogodnie będzie wykorzystać łatwo dostępne nasiona soi warzywnej Glycine max, dyni zwyczajnej Cucurbita pepo lub dyni olbrzymiej Cucurbita maxima. Nasiona mogą być suszone, ale ważne jest, żeby nie były poddawane obróbce w podwyższonej temperaturze.
Niewielką ilość zawierających ureazę nasion - ja wykorzystałem soję - należy umieścić w moździerzu (Fot.1A). Są one dosyć twarde, lecz ucierając je otrzymuje się po pewnym czasie żółtawą mączkę (Fot.1B). Proszek ten należy następnie rozprowadzić w 20-30cm3 wody o temperaturze pokojowej i przesączyć. Nie stanowi żadnego problemu jeśli przesącz pozostanie nieco mętny (Fot.2). Płyn można przechowywać kilka dni w lodówce. Bezpośrednio przed doświadczeniem dzielimy objętość roztworu na dwie części. Pierwszą należy pozostawić w spokoju, drugą natomiast zagotować przez kilka minut do wrzenia i schłodzić do temperatury pokojowej.
By przekonać się o aktywności katalitycznej ureazy należy przygotować wodny roztwór mocznika o stężeniu około 8% z dodatkiem kilku kropli alkoholowego roztworu błękitu bromotymolowego C27H28Br2O5S. Ten ostatni pełni rolę wskaźnika odczynu i przybiera w środowisku kwaśnym (pH poniżej 7) barwę żółtą, w zasadowym niebieską (pH powyżej 7), natomiast w zbliżonym do obojętnego (ph≈7) zieloną.
Uzyskany roztwór powinien mieć pH zbliżone do neutralnego lub minimalnie kwasowego. Ewentualne zabarwienie niebieskie, świadczące o zasadowym charakterze środowiska należy usunąć przez niewielki dodatek rozcieńczonego kwasu, np. octowego CH3COOH.
Przygotowany roztwór mocznika rozlewamy do trzech niewielkich zlewek. Zawartość pierwszej (Fot.3A) stanowi próbę kontrolną, do drugiej dodajemy kilka centymetrów sześciennych surowego wyciągu z nasion soi (Fot.3B), do trzeciej natomiast wyciągu zagotowanego wcześniej do wrzenia (Fot.3C). Naczynia pozostawiamy na jakiś czas w spokoju.
Już po kilku minutach można zauważyć wyraźną zmianę barwy roztworu – staje się on niebieski. Dzieje się tak jednak tylko w przypadku roztworu zawierającego surowy wyciąg z nasion soi (Fot3.E). Jest to spowodowane tym, że ureaza, jak już wspomniano, katalizuje reakcję opisaną poniższym równaniem:
Powstały amoniak w środowisku wodnym hydrolizuje dalej według:
Środowisko reakcji zostaje zalkalizowane, czego widocznym skutkiem jest zmiana barwy roztworu zawierającego wskaźnik pH.
Jeśli reakcję prowadzić dłużej, to wyraźnie wyczuwalny staje się charakterystyczny, drażniący zapach amoniaku.
Rolę ureazy podkreśla brak oznak zachodzenia jakiejkolwiek reakcji w próbce kontrolnej. Najwyraźniej ureaza rzeczywiście przyspieszyła znacznie reakcję mocznika z wodą w stosunku do reakcji bez udziału katalizatora. W rzeczywistości nawet po tygodniach oczekiwania nie zauważylibyśmy oznak zachodzenia reakcji w próbce kontrolnej.
Brak reakcji w próbce trzeciej pozwala sądzić, że podwyższona temperatura jaką potraktowano wykorzystany w tym przypadku ekstrakt sojowy spowodowała w jakiś sposób unieczynnienie enzymu. Dodatkowo, zanik funkcji ureazy jest trwały, ponieważ schłodzenie gotowanego wyciągu do temperatury pokojowej nie przywróciło jej.
Zauważmy, że ureaza może być w pewnych warunkach silną trucizną. Byłoby konieczne jednak podanie jej do krwioobiegu. W wyniku hydrolizy mocznika, który w niewielkich ilościach jest obecny w krwi, zostałaby ona zanieczyszczona toksycznym amoniakiem [8]. Na szczęście jednak spożywanie pokarmów zawierających ureazę nie niesie ryzyka – enzym zostaje po prostu strawiony podobnie jak pozostałe białka.
Peroksydazy
Kolejnymi interesującymi enzymami są peroksydazy należące do klasy oksydoreduktaz. Enzymy te katalizują reakcje utleniania różnorodnych substratów nadtlenkiem wodoru H2O2, według schematu (X – substrat, XO – produkt utleniania):
Peroksydazy występują w tkankach zarówno zwierzęcych, jak i roślinnych. Stosunkowo dużo tych substancji zawiera korzeń chrzanu pospolitego Armoracia rusticana (Fot.4), powszechnie występującej i wykorzystywanej jako przyprawa rośliny z rodziny kapustowatych Brassicaceae.
Peroksydaza pochodząca z korzenia chrzanu (ang. horseradish peroxidase, HRP) jest glikoproteiną, tj. białkiem, w którego skład wchodzą związane kowalencyjnie oligosacharydy. Jej masa cząsteczkowa wynosi 44kDa. Rolę koenzymu pełni w tym przypadku hem [9].
Aktywność peroksydazy występującej w korzeniu chrzanu można wykazać na wiele sposobów. Jednym z bardziej efektownych jest enzymatyczne utlenianie luminolu C8H7N3O2. By się o tym przekonać należy sporządzić alkaliczny roztwór chemiluminoforu poprzez rozpuszczenie w 100cm3 wody destylowanej 0,3g węglanu sodu Na2CO3 i 0,05g luminolu. W razie braku węglanu sodu alkaliczne warunki można zapewnić przez dodatek niewielkiej ilości wody amoniakalnej NH3(aq) lub ewentualnie wodorotlenku sodu NaOH.
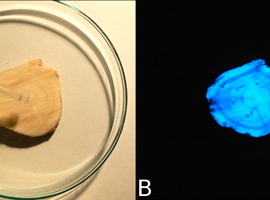
Bezpośrednio przed doświadczeniem do roztworu dodaje się jeszcze 5cm3 nadtlenku wodoru o stężeniu 3% (apteczna woda utleniona). Do tak otrzymanej cieczy należy wprowadzić następnie fragment korzenia chrzanu, najlepiej wycięty z jego wnętrza (Fot.5). W razie braku chrzanu można zastosować korzeń pietruszki zwyczajnej Petroselinum crispum, który także zawiera omawiany enzym.
Po zaciemnieniu pomieszczenia można oglądać wtedy widok jak na Fot.6. Roztwór w kontakcie z tkanką roślinną zaczyna emitować wyraźnie zauważalne światło, co jest charakterystyczne dla reakcji utleniania luminolu w środowisku zasadowym.
Doświadczenie można przeprowadzić też inaczej, tj. nanosząc pipetką pasteurowską roztwór na plaster będący przekrojem poprzecznym korzenia (Fot.7A). Można wtedy zauważyć, że luminescencja nie jest jednorodna – niektóre obszary powierzchni przekroju świecą wyraźnie słabiej niż inne. Pomijając kwestie związane z mechanicznym uszkodzeniem tkanki podczas preparowania materiału jest to spowodowane różnicami w zawartości peroksydaz.
Wiadomo, że chemiluminescencja luminolu zachodzi pod wpływem różnorodnych aktywatorów, np. rozpuszczalnych w zasadowym środowisku związków kompleksowych żelaza(III), kobaltu(II) i miedzi(II) [10]. W tym przypadku jest jednak inaczej, ponieważ to właśnie zawarta w korzeniu chrzanu peroksydaza katalizuje reakcję utleniania luminolu, co objawia się emisją niebieskiego światła.
Z racji faktu, że reakcja chemiluminescencji luminolu jest katalizowana m.in. przez hemoglobinę bywa on wykorzystywany w kryminalistyce do wykrywania obecności krwi np. w miejscu zbrodni. Plamy krwi pod wpływem luminolu zaczynają wyraźnie świecić, co może być zaobserwowane gołym okiem lub sfotografowane. Problemem jest tutaj powszechność występowania peroksydaz, które, jak się już przekonaliśmy, także katalizują tę reakcję. To samo tyczy się innych metod, np. polegających na katalitycznym utlenianiu leukobarwników, np. bezbarwnej leukofenoloftaleiny (fenoloftaliny) do różowej w środowisku zasadowym fenoloftaleiny lub nie wykazującej fluorescencji leukofluoresceiny (fluorescyny) do świecącej pod wpływem światła UV fluoresceiny [11]. Pewnym rozwiązaniem opisywanego problemu może być to, że peroksydazy, podobnie jak większość enzymów, są wyraźnie wrażliwe na podwyższoną temperaturę. Krótkie ogrzanie badanej próbki do odpowiedniej temperatury praktycznie eliminuje aktywność tych substancji, więc w razie zaistnienia wyniku pozytywnego można być bardziej pewnym obecności hemoglobiny, i co za tym idzie także krwi.
Działanie peroksydazy można wykazać też poprzez katalityczne utlenianie nadtlenkiem wodoru bezbarwnej benzydyny C12H12N2 do barwnych produktów lub utlenianie jodku potasu KI do wolnego jodu, którego obecność można łatwo wykryć przy pomocy zawiesiny skrobi ziemniaczanej [12].
Proteazy
Miano proteaz lub inaczej enzymów proteolitycznych noszą takie substancje chemiczne należące do grupy hydrolaz, które katalizują proteolizę, czyli hydrolizę wiązań peptydowych. Wiązanie peptydowe to umowna nazwa wiązania amidowego występującego między aminokwasami tworzącymi białka i peptydy.
Proteazy bywają też nazywane peptydazami. Można je podzielić na dwie główne grupy:
- egzopeptydazy – odcinają pojedyncze aminokwasy od końców łańcucha peptydowego lub białkowego,
- endopeptydazy – przecinają wiązania peptydowe wewnątrz łańcucha.
Proteazy występują u zwierząt i roślin. W obu przypadkach pełnią ważne role: w organizmach zwierzęcych np. są jednymi z enzymów trawiennych, w roślinnych natomiast często mają funkcję ochronną [13].
Proteazy występują u wielu roślin. Wspomnieć tu można o bromelinie (bromelainie) występującej np. w owocu ananasa jadalnego Ananas comosus, aktynidynie owoców aktinidii smakowitej Actinidia deliciosa lub aktinidii chińskiej Actinidia chinensis (kiwi), czy papainie występującej w niedojrzałych owocach melonowca właściwego Carica papaya, nazywanego też papają.
Aby wykazać empirycznie właściwości proteaz najłatwiej wykorzystać owoce ananasa lub kiwi. Trzeba pamiętać jedynie, by używać owoców świeżych lub mrożonych – puszkowane nie nadają się z racji zastosowanej w tym przypadku obróbki cieplnej.
Ja wykorzystałem owoc ananasa (Fot.8). Do doświadczenia są potrzebne jedynie niewielkie ilości materiału – resztę polecam wykorzystać w celu zasilenia naszego organizmu, czyli po prostu zjeść.
Ekstrakt z owocu ananasa łatwo przygotować rozcierając nieco miąższu z niewielką ilością wody, a następnie przesączając uzyskaną mieszaninę. Uzyskany płyn ma barwę żółtą (Fot.9). Można go przechowywać kilka dni w lodówce.
Jak jednak dowieść, że w owocu ananasa rzeczywiście są obecne rozkładające białka bromeliny? Można w tym celu wykorzystać żelatynę, czyli mieszaninę produktów częściowej hydrolizy kolagenu.
Należy przygotować roztwór żelatyny poprzez rozpuszczenie 10g tej substancji w 100cm3 gorącej wody. Po ochłodzeniu, ale jeszcze przed rozpoczęciem procesu żelowania do jednej próbki trzeba dodać nieco wody (próba kontrolna – Fot.10A), zaś do drugiej taką samą ilość ekstraktu ananasowego (próba badana – Fot.10B). Obie próbki trzeba odstawić na kilka godzin w chłodne miejsce.
Po pewnym czasie można zauważyć, że w przypadku próbki kontrolnej powstał sztywny żel (Fot.10C). Próbka zawierająca wyciąg z ananasa w dalszym ciągu pozostaje jednak tak samo płynna jak na początku (Fot.10D). W próbce tej nie dojdzie do wytworzenia żelu nawet po bardzo długim czasie. Jak to wyjaśnić?
Jak wiemy, w każdej temperaturze wyższej od zera absolutnego wszystkie cząstki poruszają się (drgają) z prędkościami tym większymi, im jest ona wyższa. Tak więc w gorącym roztworze żelatyny długie łańcuchy białkowe wykonują intensywne, przypadkowe ruchy. Wraz ze spadkiem temperatury ruchy te słabną i zaczynają tworzyć się wiązania wodorowe między różnymi rejonami tego samego łańcucha lub pomiędzy różnymi łańcuchami. Wiązania wodorowe są bardzo słabe, lecz w tym przypadku wraz ze spadkiem temperatury powstaje ich tak wiele, że zaczynają one grać decydującą rolę przy agregacji długich łańcuchów polipeptydowych. W obrębie powstającej struktury zostają uwięzione też cząsteczki wody, co prowadzi do powstania żelu.
W razie obecności w roztworze proteaz (np. pochodzącej z ananasa bromeliny) katalizują one hydrolityczny rozkład wiązań peptydowych. Powstają w ten sposób pojedyncze aminokwasy oraz fragmenty peptydowe, które są zbyt krótkie by wykazywać zdolność do agregacji i tworzenia żelu.
Substancją o właściwościach podobnych do żelatyny jest agar (agar-agar) pozyskiwany z morskich krasnorostów Rhodophyta. Układy zawierające agar ulegają jednak żelowaniu nawet w przypadku obecności dużych ilości proteaz (Fot.11). Łatwo to wytłumaczyć faktem, że w przeciwieństwie do żelatyny składającej się z białek i peptydów, głównym składnikiem agaru jest agaroza, czyli wielocukier będący polimerem pochodnych galaktozy C6H12O6. Proteazy nie katalizują rozkładu cukrów, więc nie mają wpływu na proces zestalania się roztworów zawierających agar.
Zauważmy, że z przedstawionego doświadczenia wynika, że nie da się sporządzić galaretki o smaku ananasa, kiwi lub papai w oparciu o żelatynę i naturalne soki z tych owoców. Odpowiednio podwyższona temperatura oczywiście dezaktywuje enzymy, ale zmienia też smak galaretki, co może być niekorzystne. Mimo wszystko, takie desery można oczywiście przyrządzić przy wykorzystaniu agaru.
Amylazy
Amylazy lub inaczej enzymy amylolityczne są podobnie jak proteazy i ureazy zaliczane do hydrolaz. Katalizują one jednak rozkład nie białek lub mocznika, a skrobi i innych polisacharydów [14]. U zwierząt występują między innymi w ślinie i soku trzustkowym, zaś u roślin np. w owocach lub kiełkujących nasionach.
Z racji dostępności surowca postaramy się potwierdzić amylolityczne właściwości amylazy ślinowej (dawniej nazywanej ptialiną).
By sporządzić roztwór wyjściowy, należy rozprowadzić kilka gramów skrobi ziemniaczanej w 100cm3 gorącej wody, po czym przesączyć i ochłodzić.
Roztworem skrobi napełniamy trzy probówki. Pierwsza, tj. bez żadnych dodatków, będzie stanowić próbę kontrolną (Fot.12A). Do drugiej należy dodać niewielką ilość śliny rozcieńczonej pięciokrotnie wodą destylowaną (Fot.12B), zaś do trzeciej podobną ilość roztworu śliny doprowadzonego na krótko do wrzenia (Fot.12C). Ciecz we wszystkich probówkach jest bezbarwna. Roztwory pozostawiamy na przeciąg godziny lub dwóch w temperaturze pokojowej. Jeśli natomiast podgrzejemy je do temperatury około 37°C to wystarczy już kilkanaście minut.
Po upływie tego czasu należy zbadać zawartość naczyń. Wszystkie trzy roztwory zdają się nie wykazywać oznak żadnych zmian – ciecz jest w dalszym ciągu bezbarwna (Fot.12D, E, F). Chcąc się jednak przekonać o zawartości skrobi wystarczy dodać do nich kilka kropli aptecznej jodyny, czyli alkoholowego lub wodnego (z dodatkiem jodku potasu KI) roztworu jodu.
Wynik może być pewnym zaskoczeniem, ponieważ charakterystyczne granatowe zabarwienie kompleksu jodu ze skrobią można zaobserwować jedynie w przypadku roztworu nie zawierającego amylazy (Fot.12G) oraz tego, w skład którego wchodził roztwór amylazy podgrzany wcześniej do temperatury wrzenia (Fot.12I), co spowodowało dezaktywację enzymu. W przypadku roztworu zawierającego amylazę nie zaobserwowano granatowego zabarwienia kompleksu, a jedynie brązowe pochodzące od rozpuszczonego jodu. Najwyraźniej enzym rzeczywiście spowodował rozkład długołańcuchowych polisacharydów wchodzących w skład skrobi, do krótszych, które nie dają zabarwienia z jodem.
Amylaza ślinowa rozkłada skrobię na maltozę i dekstryny, co można traktować jako wstępny etap trawienia polisacharydów, który rozpoczyna się już w jamie ustnej.
Wyjaśnienie
Jak widać, enzymy nie tylko występują praktycznie wszędzie wokół nas (i w nas samych), ale też nie jest wcale trudno je wykryć i przekonać się samodzielnie o ich właściwościach.
Enzymy to w większości łańcuchy białkowe o zróżnicowanej długości, od kilkudziesięciu (np. tautomeraza 4-oksokrotonianu) do ponad 2500 aminokwasów w łańcuchu (zwierzęca syntaza kwasów tłuszczowych) [15] [16]. Rejon łańcucha, który wiąże się i oddziałuje z substratem oraz zawiera kluczowe dla przebiegu reakcji aminokwasy nazywany jest centrum aktywnym enzymu. Prócz substratu enzymy mogą wiązać także inne cząsteczki, np. kofaktory mogące regulować aktywność katalityczną.
W komórkach żywych enzymy są syntezowane przy udziale rybosomów jako długie łańcuchy aminokwasowe, które nabierają potem odpowiedniej struktury przestrzennej. Właściwości enzymu są określane właśnie przez konformację przestrzenną. Wysoka temperatura powoduje denaturację białek, czyli pewne zmiany w strukturze, co pociąga za sobą oczywiście utratę aktywności katalitycznej. Zaobserwowaliśmy to w odniesieniu do opisywanych enzymów.
Wpływ temperatury w przedziale niedenaturującym na działanie enzymów jest także łatwy do zaobserwowania, szczególnie w przypadku amylazy – im wyższa temperatura, tym szybszy postęp reakcji. Większość enzymów działa z największą wydajnością w określonym przedziale temperatury i pH środowiska.
Charakterystyczna dla enzymów jest także bardzo wysoka specyficzność substratowa, z reguły znacznie wyższa niż specyficzność katalizatorów nieorganicznych. Zauważmy, że proteazy pochodzące z ananasa rozłożyły jedynie białka wchodzące w skład żelatyny, nie dając żadnego zauważalnego skutku w przypadku agaru. Może to nieco dziwić, bo przecież zarówno białka, jak i polisacharydy są zbudowane z długich polimerycznych łańcuchów. Enzymy wykazują często nawet dużo dalej idącą specyficzność co do substratów katalizowanych reakcji. Mechanizm reakcji enzymatycznych bywa opisywany za pomocą wielu teoretycznych modeli, np. „klucza i zamka” (ang. „lock and key”), trzypunktowego dołączenia (ang. three-point interaction model) i indukowanego dopasowania (ang. induced fit model).
Badaniem wszystkich aspektów mających związek z występowaniem, budową i rolą enzymów, a także mechanizmami ich działania oraz wykorzystaniem zajmuje się prężnie rozwijająca dziedzina wiedzy jaką jest enzymologia.
Na działanie enzymów wpływ mają też inne czynniki, np. obecność jonów metali. Można w tej dziedzinie przeprowadzić wiele interesujących doświadczeń, do czego gorąco zachęcam Czytelnika.
Literatura:
- [1] Lindskog S., Structure and mechanism of carbonic anhydrase, Pharmacology & therapeutics, 1 (74), 1997, str. 1–20 powrót
- [2] Stryer L., Biochemia, Wyd. 6, Wydawnictwo Naukowe PWN, Warszawa, 2009 powrót
- [3] de Réaumur R. A. F., Observations sur la digestion des oiseaux, Histoire de l’academie royale des sciences, 461, 1752, str. 266 powrót
- [4] Buchner E., Cell-free fermentation, Nobel Lectures, Chemistry 1901-1921, Elsevier Publishing Company, Amsterdam, 1966 powrót
- [5] Moss G. P., Recommendations of the Nomenclature Committee, w: International Union of Biochemistry and Molecular Biology on the Nomenclature and Classification of Enzymes by the Reactions they Catalyse, dostępne online: http://www.chem.qmul.ac.uk/iubmb/enzyme/ [dostęp: 23.04.2016] powrót
- [6] Carter E. L., Flugga N., Boer J. L., Mulrooney S. B., Hausinger R. P., Interplay of metal ions and urease, Metallomics, 1 (3), 2009, str. 207–221 powrót
- [7] Karplus P. A., Pearson M. A., Hausinger R. P., 70 years of crystalline urease: What have we learned?, Accounts of Chemical Research, 30 (8), 1997, str. 330–337 powrót
- [8] Pluciński T., Doświadczenia chemiczne, Wydawnictwo Adamantan, Warszawa, 1997, str. 97 powrót
- [9] Veitch N. C., Horseradish peroxidase: a modern view of a classic enzyme, Phytochemistry, 65 (3), 2004, str. 249–259 powrót
- [10] Ples M., Widmowy blask. Chemiluminescencja katalizowana kompleksem miedzi, Chemia w Szkole, 2 (2016), Agencja AS Józef Szewczyk, str. 13-17 powrót
- [11] Ples M., Na tropie - fluorescencyjne wykrywanie śladów krwi, Chemia w Szkole, 1 (2015), Agencja AS Józef Szewczyk, str. 25-26 powrót
- [12] Pluciński T., Doświadczenia chemiczne, Wydawnictwo Adamantan, Warszawa, 1997, str. 92 powrót
- [13] Hattori M., Hirayama C., Konno K., Nakamura M. et al, Papain protects papaya trees from herbivorous insects: role of cysteine proteases in latex, The Plant Journal, 37 (3), 2004, str. 370 - 378 powrót
- [14] Konturek S., Fizjologia układu trawiennego, Państwowe Zakłady Wydawnictw Lekarskich, Warszawa, 1985 powrót
- [15] Chen L. H., Kenyon G. L., Curtin F., Harayama S., Bembenek M. E., Hajipour G., Whitman C. P., 4-Oxalocrotonate tautomerase, an enzyme composed of 62 amino acid residues per monomer, The Journal of Biological Chemistry, 25 (267), 1992, str. 17716–17721 powrót
- [16] Smith S., The animal fatty acid synthase: one gene, one polypeptide, seven enzymes, The FASEB Journal, 15 (8), 1995, str. 1248–1259 powrót
Uzupełnienie autora
Poniżej przedstawiam film ukazujący opisane powyżej doświadczenie z peroksydazą chrzanową.
Marek Ples