Fiolet świeci
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (6/2018):

Myślę, że nie muszę przekonywać Szanownych Czytelników, że chemia i w ogóle nauki przyrodnicze są bardzo ciekawymi dziedzinami. Jak jednak przekonać o tym innych, którym nauka – zarówno w sensie poznawczym, jak i dydaktycznym – wydaje się być czymś trudnym, skomplikowanym, a przy tym mało interesującym?
Pomocą mogą być tutaj wszelkiego rodzaju ciekawostki naukowe. Ich rolą jest zaciekawienie, a więc pochwycenie uwagi widza na tę chwilę, która wystarczy by mógł się on zastanowić nad mechanizmami obserwowanego zjawiska. W części przypadków – oby jak największej – będzie to początkiem chęci poszerzenia wiedzy, poszukiwania nowych informacji i wejścia na ścieżkę zrozumienia…
Jedną z bardziej efektownych, a przy tym interesujących ciekawostek chemicznych są wszelkiego rodzaju reakcje chemiluminescencyjne, czyli takie, w których dochodzi do emisji światła nie związanej z przyczyną termiczną. Istnieje wiele reakcji tego typu, ale może wydać się zaskakujące, że nawet tak powszechnie dostępna w aptekach i stosunkowo mało toksyczna substancja jaką jest manganian(VII) potasu w odpowiednich warunkach umożliwia zaobserwowanie chemiluminescencji.
Nie poprzestaniemy oczywiście na rozważaniach teoretycznych, ponieważ przeprowadzenie doświadczenia nie jest skomplikowane.

Doświadczenie
Przygotowanie doświadczenia wymaga od nas skompletowania substancji z poniższej listy:
- manganian(VII) potasu KMnO4,
- borowodorek sodu NaBH4,
- heksametafosforan(V) sodu (NaPO3)6,
- kwas siarkowy(VI) H2SO4 - roztwór 20%,
- wodorotlenek sodu(VI) NaOH - roztwór 10%.
Do przygotowania wszystkich opisywanych roztworów należy użyć wody destylowanej.
Manganian(VII) potasu jest często nazywany też nadmanganianem potasu i znajduje bardzo szerokie zastosowanie m.in. w przemyśle i analizie chemicznej, a także w lecznictwie jako środek dezynfekcyjny [1]. Można go z łatwością kupić w aptekach – z racji swojej barwy bywa nazywany “fioletem” (trzeba jednak pamiętać, że podobnie nazywa się wiele innych substancji, choćby także stosowany w podobnych celach fiolet gencjanowy). W warunkach normalnych związek ten ma postać ciemnofioletowych, prawie czarnych kryształów (Fot.1).
Omawiana sól dosyć dobrze rozpuszcza się w wodzie. Po wrzuceniu do wody nawet mikroskopijnych kryształków manganianu(VII) można zauważyć ciągnące się za nimi charakterystyczne smugi (Fot.2A), a roztwory już przy bardzo niewielkich stężeniach mają łatwą do rozpoznania fioletową barwę (Fot.2B).
Manganian(VII) potasu mimo zastosowania w lecznictwie - coraz rzadszego zresztą - działa szkodliwie na nasz organizm, szczególnie przy większej ekspozycji. Przy manipulacjach z tą substancją trzeba też zawsze pamiętać o jej silnych właściwościach utleniających, ponieważ mieszaniny z reduktorami mogą być niestabilne.
Borowodorek sodu jest nieorganicznym związkiem chemicznym z grupy wodorków. Jest białym ciałem stałym, w handlu występującym często w postaci granulatu (Fot.3). Wykorzystywany jest głównie jako reduktor.
Borowodorek z łatwością reaguje z wodą – nawet w postaci pary wodnej z powietrza – według równania reakcji:
W czasie reakcji powstaje łatwopalny wodór. Z tego powodu borowodorek sodu musi być przechowywany w pojemnikach bez dostępu wilgoci. Związek ten działa także niszcząco na tkanki naszego ciała oraz jest toksyczny. Z tych powodów należy zachować ostrożność przy pracy z nim.
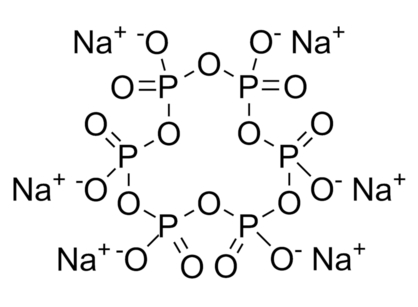
Heksametafosforan(V) sodu jest nieorganicznym związkiem chemicznym, a konkretniej solą kwasu metafosforowego(V) i sodu. Jego interesujący wzór strukturalny przedstawia Rys.1.
Substancja ta znajduje zastosowanie jako środek zmiękczający wodę w przemyśle skórzanym, włókiennicznym, szklarskim, barwnikarskim i innych. Wchodzi także w skład wielu środków piorących [2]. Związek jest sklasyfikowany na liście chemicznych dodatków do żywności jako E452i, w klasie zawierającej emulgatory, środki spulchniające i żelujące (E400 – 499). Heksametafosforan(V) nie jest toksyczny, nie powoduje też innego znaczącego zagrożenia.
W warunkach normalnych heksametafosforan(V) sodu ma postać białego proszku krystalicznego (Fot.4).
Roztwory kwasu siarkowego(VI) i wodorotlenku sodu należy przygotowywać wyjątkowo ostrożnie, ponieważ obie substancje są silnie żrące i mogą spowodować niebezpieczne oparzenia.
Wszystkie manipulacje z chemikaliami należy wykonywać z wykorzystaniem środków ochrony osobistej, a także przy jak największej uwadze i ostrożności. Powtarzam to, ponieważ wiem, jak łatwo popaść w rutynę. Bezpieczeństwo jest jednak najważniejsze.
Przystępując do wykonania doświadczenia musimy przygotować dwa roztwory:
- A – 0,1g manganianu(VII) potasu, 2g heksametafosforanu(V) sodu w 50cm3 wody z dodatkiem 1cm3 kwasu siarkowego(VI) o stężeniu 20%,
- B – 1g borowodorku sodu w 10cm3 wody z dodatkiem 1cm3 wodorotlenku sodu o stężeniu 10% [3].
Rozpuszczenie wszystkich substancji może wymagać dosyć energicznego mieszania. Roztwór A przy stosunkowo dużym stężeniu manganianu ma tak ciemny kolor fioletowy, że może on się wydawać wręcz czarny (Fot.5). Jest on dosyć trwały i – szczególnie w obniżonej temperaturze oraz bez dostępu światła – może być przechowywany przez pewien czas.
Roztwór B jest bezbarwny (Fot.6). Jak już wspominałem wcześniej, borowodorek ulega rozkładowi w kontakcie z wodą, tak więc ten roztwór powinien zostać przygotowany dopiero w ostatniej chwili przed doświadczeniem.
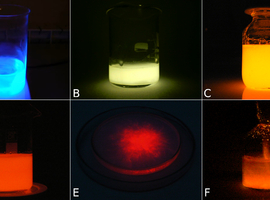
Mając przygotowane oba roztwory możemy przystąpić do doświadczenia. W wysokiej zlewce o pojemności przynajmniej 100cm3 umieszczamy roztwór A i zaczynamy go intensywnie mieszać (Fot.7A). Przydatne w tym celu jest mieszadło magnetyczne. Ciągle mieszając dodajemy następnie do naczynia 2-3cm3 roztworu B. Pociąga to za sobą bardzo intensywne pienienie się roztworu (Fot.7B), który po chwili staje się całkowicie bezbarwny (Fot.7C).
Tak przedstawia się sytuacja, jeśli obserwacje prowadzimy na świetle. Spróbujmy jednak w ten sam sposób zmieszać oba roztwory w ciemności. Można wtedy stwierdzić, że zaobserwowanemu uprzednio pienieniu się roztworu i zanikowi barwy towarzyszy krótka, ale dosyć intensywna emisja czerwono-pomarańczowego światła (Fot.8).
Obserwowane światło powstaje na drodze chemiluminescencji, tzn. nie ma ono charakteru promieniowania termicznego. Widziany przez nas blask powstaje kosztem energii wiązań chemicznych reagentów.
Wyjaśnienie
Przedstawiona reakcja chemiluminescencyjna zachodzi według równania:
Jak widać, wśród reagentów występują aniony manganianowe(VII) MnO4− i borowodorkowe BH4−, oraz kationy wodorowe H+. Heksametafosforan(V) sodu pełni funkcję pomocniczą. W reakcji poza wodą H2O, kwasem borowym H3BO3 powstają też jony manganianowe(II) Mn2+. To właśnie one pełnią kluczową rolę w procesie chemiluminescencji, ponieważ początkowo występują w tzw. stanie wzbudzonym, o wysokiej energii. Sytuacja taka jest jednak nietrwała – jon bardzo szybko przechodzi do trwałego termodynamicznie stanu podstawowego:
Zgodnie z zasadą zachowania różnica energii między stanem wzbudzonym a podstawowym zostaje oddana do środowiska. W większości przypadków dzieje się to na sposób ciepła, ale w chemiluminescencji część wspomnianej energii zostaje przekształcona w promieniowanie elektromagnetyczne z zakresu światła widzialnego. Energię niosących ją fotonów wyraża iloczyn stałej Plancka h i częstotliwości drgań ν. W tym przypadku długość fali w maksimum emisji wynosi około 690 nanometrów, co odpowiada światłu czerwonemu.
Przedstawiony schemat reakcji X → [Y]* → Y + hν, w którym substrat (substraty) X przekształca się we wzbudzony produkt przejściowy [Y]*, spontanicznie oddający energię hν i przyjmujący ostatecznie postać Y jest charakterystyczny dla praktycznie wszystkich reakcji chemiluminescencji. Wiele znanych chemiluminoforów to związki organiczne: luminol C8H7N3O2 (Fot.9A), lofina C21H16N2 (Fot.9B), pochodne organicznych szczawianów uczulane odpowiednimi sensybilizatorami (Fot.9C), lucygenina C28H22N4O6, lucyferyna C11H8N2O3S2, a nawet polifenole obecne w zielonej herbacie (Fot.9D). Chemiluminescencja związków nieorganicznych występuje rzadziej, niemniej jednak jest znanych także wiele przykładów tego zjawiska. Na łamach “Chemii w Szkole” opisywałem już chemiluminescencję singletowej odmiany tlenu 1O2 (Fot.9E), metalicznego sodu Na - najwyraźniej podobną w swym mechanizmie do świecenia białej odmiany alotropowej fosforu P – oraz bardzo ciekawego związku krzemu, czyli Si6O3H6 nazywanego siloksenem Wöhlera (Fot.9F) [4] [5] [6].
Jak widać, także związki manganu są zdolne do chemiluminescencji. Można zmodyfikować doświadczenie wykorzystując zróżnicowane związki tego metalu. Łatwo się przekonać, że występuje tu pewna zależność. Związki, w których mangan występuje na VII stopniu utleniania w wyniku opisanej reakcji dają najjaśniejsze światło. Jeśli weźmiemy pod uwagę związki manganu na innych stopniach utleniania (IV, III) to zauważymy, że intensywność chemiluminescencji spada wraz z tą wartością. Jeśli wykorzystamy związek manganu(II) to nie zaobserwujemy żadnej emisji światła [7]. Powód stanie się dosyć jasny, jeśli zwrócimy uwagę, że wzbudzony jon Mn2+ powstaje tutaj w wyniku redukcji związków manganu na wyższych stopniach utleniania.
Literatura:
- [1] Fatiadi A. J., The Classical Permanganate Ion: Still a Novel Oxidant in Organic Chemistry, Synthesis, 02, 1987, str. 85-127 powrót
- [2] Hassa R., Mrzigod J., Podręczny słownik chemiczny (wyd. I), Videograf II, Katowice, 2004, str. 65 powrót
- [3] Albrecht S., Brandl H., Zimmermann T., Anorganische Chemilumineszenz. Traditionelle Experimente in neuem Licht, Chemie in unserer Zeit, 42 (6), 2008, str. 394-400 powrót
- [4] Ples M., Chemiluminescencja metalicznego sodu, Chemia w Szkole, 1 (2014), Wydawnictwo EduPress, str. 5-7 powrót
- [5] Ples M., Światło z retorty, Chemia w Szkole, 5 (2014), Agencja AS Józef Szewczyk, str. 33-34 powrót
- [6] Ples M., Co i jak można otrzymać z piasku? Nieznane oblicze krzemu, Chemia w Szkole, 6 (2016), Agencja AS Józef Szewczyk, str. 38-43 powrót
- [7] Barnett N. W., Hindson B. J., Jones P., Lenehan C. E., Russell R. A., New light from an old reagent: Chemiluminescence from the reaction of potassium permanganate with sodium borohydride, Australian Journal of Education in Chemistry, 65, 2005, str. 29-31 powrót
Wszystkie fotografie i rysunki zostały wykonane przez autora
Marek Ples