Fotoogniwo uczulane barwnikiem
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (3/2017):

Czego możemy nauczyć się od natury?
Zasada zachowania energii mówi, że nie może ona powstać z niczego, ani zniknąć bezpowrotnie. Skąd więc pochodzi cała energia, z której korzystamy w naszym życiu? Chwila zastanowienia wystarczy, by stwierdzić, że głównym źródłem tej energii jest Słońce.
Energia niesiona przez światło słoneczne zostaje przekształcona przez rośliny na drodze fotosyntezy w energię wiązań chemicznych związków budujących ich ciała. Rośliny oraz inne organizmy prowadzące fotosyntezę są podstawą wszelkich systemów przemiany materii i energii na Ziemi. Również wykorzystywane przez nas paliwa kopalne wzięły swój początek z rozkładających się ciał organizmów roślinnych.
Nie cała energia promieniowania słonecznego trafiającego do górnych warstw atmosfery ziemskiej dociera do powierzchni planety. Około 50% tego promieniowania zostaje odbite w kosmos lub pochłonięte w atmosferze. Sumaryczna energia, jaka dociera do poziomej powierzchni w ciągu jednego roku wynosi od 600 kWh/m2 w krajach skandynawskich do ponad 2500 kWh/m2 w centralnej Afryce [1].
Energia słoneczna jest więc powszechnie dostępna. Fakt, że korzystamy do tej pory głównie z paliw kopalnych powodujących duże zagrożenie dla środowiska jest spowodowany trudnościami natury technicznej. Energetyka słoneczna jest gałęzią przemysłu zajmująca się wykorzystaniem energii promieniowania słonecznego, która jest zaliczana do odnawialnych źródeł energii. Jest to dziedzina stosunkowo młoda, ale od początku XXI wieku zanotowano znaczne przyspieszenie w kwestii jej rozwoju.
Jeśli chodzi o przekształcanie energii świetlnej promieniowania słonecznego w użyteczne dla człowieka formy energii to najpowszechniej wykorzystuje się dzisiaj dwie metody:
- konwersja fotowoltaiczna – bezpośrednie przekształcanie energii świetlnej w energię elektryczną,
- konwersja fototermiczna – bezpośrednie przekształcanie energii świetlnej w energię cieplną.
Inne metody, np. konwersja fotochemiczna na dzień dzisiejszy mają dużo mniejsze znaczenie.
Konwersja fototermiczna wykorzystywana jest jest najczęściej do podgrzewania wody. Istnieją zarówno niewielkie przydomowe instalacje tzw. kolektorów słonecznych, jak i duże ciepłownie dostarczające podgrzaną w ten sposób wodę do zróżnicowanych odbiorców.
Konwersję fotowoltaiczną prowadzi się natomiast przy wykorzystaniu elementów nazywanych ogniwami fotowoltaicznymi lub fotoogniwami – często są one dosyć obrazowo nazywane ogniwami słonecznymi.
Fotoogniwa są wytwarzane z materiałów półprzewodnikowych, dziś najczęściej z krzemu Si, a dawniej z selenu Se (Fot.1).
Pojedyncze ogniwo z krystalicznego krzemu wytwarza nominalnie napięcie ok. 0,5 wolta. Dzięki połączeniu szeregowemu wielu fotoogniw można otrzymać baterie słoneczne o wymaganej wartości wytwarzanego napięcia i natężenia prądu.
Produkcja krzemowych ogniw słonecznych jest w dalszym ciągu dosyć kosztowna, ponieważ wymaga stosowania stosunkowo drogich materiałów otrzymywanych na drodze skomplikowanych procesów przemysłowych, np. monokryształów krzemu.
W związku z coraz większym zapotrzebowaniem na tanie źródła energii odnawialnej prowadzi się dziś badania nad wieloma nowymi typami fotoogniw. Obiecujące są prace nad tzw. fotoogniwem uczulanym barwnikiem (ang. Dye-Sensitized Solar Cell, DSSC). Ogniwo takie zostało wynalezione w 1988 roku przez Briana O'Regana and Michaela Grätzela na Uniwersytecie Kalifornijskim w Berkeley. Często nazywa się je skrótowo fotoogniwem barwnikowym. Działa one w oparciu o proces podobny do roślinnej fotosyntezy [2].
O ile trudno sobie wyobrazić produkcję fotoogniw krzemowych w warunkach szkolnego czy nawet uczelnianego laboratorium w celach edukacyjnych, to chciałbym zaproponować Szanownemu Czytelnikowi budowę uproszczonego (ale działającego) fotoogniwa uczulanego barwnikiem.
Budowa
Schemat budowy prostego fotoogniwa barwnikowego ilustruje Rys.1.

Materiały potrzebne do konstrukcji ogniwa są stosunkowo łatwe do zdobycia, a budowa na tyle nieskomplikowana, że można pokusić się o jego budowę w warunkach nawet średnio wyposażonego laboratorium.
Elektrodami zbiorczymi, a jednocześnie głównymi elementami nośnymi ogniwa są dwie płytki wykonane ze szkła. Czy nie można tych elektrod zastąpić elektrodami metalicznymi? Niestety odpowiedź jest przecząca, przynajmniej w stosunku do elektrody górnej na Rys.1, ponieważ musi ona przepuszczać światło widzialne.
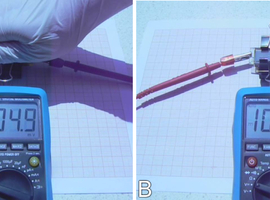
Z tego powodu obie elektrody są wykonane z płytek szklanych powleczonych cienką warstwą materiału przewodzącego elektryczność. W moim przypadku jest to tak zwana warstwa ITO, czyli wykonana z mieszanego tlenku indu i cyny (ang. Indium Tin Oxide) wykazującego właściwości półprzewodnikowe [3]. Można też wykorzystać inne podobne materiały. Cienka ceramiczna warstwa tego materiału jest przezroczysta i dosyć dobrze przewodzi prąd elektryczny. Trzeba jednak pamiętać o tym, że dostępne komercyjnie tzw. szkło przewodzące posiada warstwę ITO najczęściej jedynie na jednej ze swoich powierzchni. Aby móc stwierdzić, która z powierzchni płytki przewodzi prąd najwygodniej jest posłużyć się omomierzem (Fot.2).
Jak widać, opór elektryczny powierzchni zwykłego szkła jest bardzo wysoki i na odcinku około 2cm wynosi ponad 20MΩ (Fot.2A i C).
Powierzchnia pokryta półprzewodnikiem wykazuje natomiast stosunkowo niski opór elektryczny i dla elektrod umieszczonych w podobnej odległości co w poprzednim przypadku jego wartość wynosi jedynie około 120Ω (Fot.2B i D). Tak więc rzeczywiście możemy użyć tego rodzaju szkła w charakterze przejrzystych dla światła widzialnego elektrod.
W moich doświadczeniach wykorzystałem płytki szklane w kształcie prostokąta o wymiarach 5cm na 2cm. Można użyć płytek o większej powierzchni, co umożliwi uzyskanie ogniwa o większej wydajności prądowej.
Na powierzchni przewodzącej jednej z płytek musimy wytworzyć aktywną część naszego fotoogniwa czyli jego fotoanodę. Będzie ona zbudowana z porowatej warstwy cząstek półprzewodnika uczulonej odpowiednim barwnikiem.
Jako półprzewodnik wykorzystamy tlenek tytanu(IV) o wzorze TiO2, nazywany inaczej bielą tytanową. Ma on postać białego proszku o temperaturze topnienia ok. 1830°C (Fot.3). Tlenek tytanu(IV) jest najpowszechniej spotykanym i najtrwalszym tlenkiem tytanu [4]. Związek ten występuje naturalnie w trzech odmianach polimorficznych jako minerały rutyl, anataz i brukit. Tlenek tytanu(IV) znajduje zastosowanie jako trwały biały pigment.
Do naszych celów jest potrzebny jak najdokładniej rozdrobniony tlenek. W razie trudności w jego pozyskaniu można spróbować wyizolować go np. z niektórych past do zębów [5].
Aby móc nałożyć cienką porowatą warstwę tlenku tytanu(IV) na przewodzącą powierzchnię płytki szklanej musimy wykonać z niego rodzaj białej farby. W tym celu do niewielkiego naczynia przenosimy około 0,25g tlenku, a następnie dodajemy mieszając za każdym razem po kropli 10% roztworu kwasu octowego CH3COOH. Można w tym celu zastosować czysty ocet spożywczy, tzw. spirytusowy. Z powodzeniem można też wykorzystać rozcieńczony roztwór kwasu azotowego(V) HNO3. Kwasu dodajemy tyle, by powstała dosyć rzadka pasta o konsystencji farby. Na końcu do płynu dodajemy dosłownie kroplę detergentu i od tego czasu unikamy wstrząsania naczyniem, tak by nie wytworzyć trudnej do usunięcia piany. Uzyskana w ten sposób farba jest gotowa (Fot.4). Oczywiście po pewnym czasie tlenek tytanu(IV) ulega sedymentacji, ale wystarczy wtedy delikatnie zamieszać ciecz.
Skoro farba jest już gotowa to czy możemy przystąpić już do jej nakładania na płytkę szklaną? Tutaj występuje jednak pewien problem, ponieważ warstwa tlenku powinna być jak najbardziej jednorodna, a jej grubość musi być rzędu mikrometrów. Taki rezultatów nie zapewniłoby nam z pewnością wykorzystanie malarskiego pędzla. Sprawa mogłaby wydawać się beznadziejna, ale z pomocą przychodzi nam w tym przypadku taśma klejąca. Grubość zwykłej biurowej taśmy klejącej wraz z warstwą kleju jest odpowiednia, aby ją wykorzystać jako swego rodzaju szablon przy nakładaniu na szkło warstwy farby. Najprościej jest to zrobić oklejając z trzech stron powierzchnię ITO płytki szklanej taśmą klejącą w sposób ukazany na Fot.5. Powierzchnie oklejone taśmą powinny mieć kilka milimetrów szerokości, tak aby odkryty obszar miał dosyć dużą powierzchnię w porównaniu do całej płytki.
W ten prosty sposób uzyskaliśmy nieckę o szerokości i długości rzędu centymetrów oraz o głębokości rzędu ułamka milimetra.
Na brzeg niecki (od strony krótszego brzegu zaklejonego taśmą) należy nanieść kilka kropli farby tytanowej (Fot.6).
Teraz trzeba przygotować jak najprostszy, gładki pręcik szklany np. bagietkę. Przykładając jej boczną powierzchnię do płytki i przesuwając po powierzchni taśmy możemy łatwo rozsmarować farbę tworząc dosyć jednorodną powierzchnię wymaganej grubości (Fot.7).
W razie wystąpienia problemów z nakładaniem farby należy poeksperymentować z jej konsystencją np. poprzez większy dodatek kwasu tak aby stała się bardziej płynna.
Po lekkim podeschnięciu można delikatnie usunąć taśmę (Fot.8). Radzę jednak nie czekać z tym do całkowitego wyschnięcia, ponieważ warstwa tlenku tytanu(IV) staje się wtedy bardzo krucha i łatwo oderwać jej fragmenty razem z taśmą klejącą.
Tak uzyskana warstwa tlenku tytanu nie jest jeszcze dobrze związana z powierzchnią ITO płytki szklanej, a ponadto zawiera dodatek kwasu i detergentu. W jednym kroku możemy jednak rozwiązać oba te problemy. Pomoże nam w tym wysoka temperatura.
Płytkę należy ogrzewać do temperatury co najmniej 350°C w czasie około 45 minut np. na płytce kuchenki elektrycznej (Fot.9).
W literaturze można się też spotkać z informacją o wygrzewaniu płytek do temperatury 450°C – wtedy wystarczy jedynie 30 minut [6]. W każdym przypadku temperatura podczas ogrzewania powinna być podnoszona, a podczas schładzania obniżana stosunkowo powoli. Zbyt gwałtowne zmiany temperatury mogą doprowadzić do spękania warstwy tlenku tytanu(IV).
W czasie wygrzewania płytki można zauważyć, że warstwa tlenkowa przejściowo traci swoją białą barwę i staje się delikatnie żółta. Jest to spowodowane rozkładem substancji organicznych (głównie detergentu) wchodzących w skład użytej farby. Po chwili jednak warstwa staje się na powrót śnieżnobiała, ponieważ zanieczyszczenia w wyniku utlenienia ulatniają się w postaci gazów, głównie pary wodnej i dwutlenku węgla. Tak więc po wygrzewaniu uzyskujemy dosyć dobrze związaną z powierzchnią płytki i wystarczająco czystą do dalszych prac warstwę tlenku tytanu(IV).
Fotoanoda nie jest jednak w dalszym ciągu gotowa. Brakuje najważniejszego jej elementu, tj. barwnika. Na szczęście nie jest on trudny do pozyskania. W moim przypadku jako jego źródło wykorzystałem owocujące w moich ogrodzie maliny (Fot.10).
W razie braku świeżych owoców można oczywiście wykorzystać maliny mrożone. Zachęcam do eksperymentów także z innymi owocami, np. jeżynami i jagodami.
Nie ma w tym przypadku potrzeby wprowadzenia specjalnej procedury ekstrakcji barwnika. Owoce wystarczy rozgnieść, ewentualnie dodając minimalną ilość wody destylowanej. Przygotowaną w ten sposób papkę należy delikatnie nałożyć na przygotowaną wcześniej elektrodę i pozostawić na parę godzin (Fot.11).
Po upływie wymaganego czasu papkę trzeba zmyć powolnym strumieniem wody destylowanej, tak aby nie uszkodzić delikatnej warstwy tlenku tytanu(IV).
Następnie, w celu wypłukania barwnika niezwiązanego do powierzchni płytkę należy ostrożnie przemyć alkoholem etylowym C2H5OH i wysuszyć.
Przygotowane w ten sposób fotoanody można przechowywać w naczyniu wypełnionym wodą destylowaną delikatnie zakwaszoną kwasem octowym. Przed wykorzystaniem należy w takim wypadku oczywiście ponownie przemyć płytki alkoholem i wysuszyć. Ważne jest by gotowe płytki przed wykorzystaniem ich w ogniwach przechowywać bez dostępu światła, ponieważ mogłoby ono spowodować rozkład barwnika.
Teraz kolej na katodę. Musi być ona zbudowana z materiału przewodzącego prąd elektryczny, a przy tym wykazującego odpowiednie właściwości katalityczne. Najlepsza byłaby tu platyna Pt, ale z racji jej wysokiej ceny oraz niskiej dostępności chciałbym zaproponować wykorzystanie jako katalizatora cienkiej warstwy silnie rozdrobnionego węgla.
Tutaj napotykamy problem podobny do tego przy nakładaniu cienkiej warstwy tlenku tytanu(IV) na płytkę szkła przewodzącego. W tym przypadku rozwiązanie będzie jednak prostsze niż poprzednio. Jako źródło silnie rozdrobnionego węgla wykorzystamy bowiem sadzę powstającą w płomieniu zwykłej świecy na skutek niepełnego spalania parafiny lub stearyny. Wystarczy więc przeciągnąć kilka razy przez płomień płytkę szkła (trzymaną w szczypcach warstwą ITO do dołu), aby zdeponować na jej powierzchni odpowiednią ilość sadzy (Fot.12).
Po ostygnięciu należy za pomocą bibuły delikatnie usunąć czarną warstwę węgla z tych miejsc katody, które odpowiadają niepokrytym tlenkiem tytanu(IV) miejscom na fotoanodzie. Gotowe elektrody są przedstawione na Fot.13.
Chciałbym zwrócić uwagę, że uprzednio biała fotoanoda przybrała barwę charakterystyczną dla związanego barwnika.
Ostatnim elementem potrzebnym do budowy ogniwa jest elektrolit jodkowy. Przygotowuje się go poprzez odważenie 0,05g jodu I i 0,4g jodku potasu KJ. Obie substancje umieszczamy w niewielkim naczyniu (Fot.14).
Chociaż jodek potasu jest białym ciałem krystalicznym to po zmieszaniu z odważoną ilością jodu niemal natychmiast nabiera żółtawej barwy na skutek kontaktu z jego parami.
Substancje stałe należy następnie rozpuścić w 5cm3 glikolu etylenowego C2H6O2. Wymaga to dosyć intensywnego mieszania. Gotowy elektrolit ma wygląd brunatnej cieczy (Fot.15).
Składniki elektrolitu nie są silnie toksyczne, ale mogą wykazywać szkodliwe działanie. Krystaliczny jod ma działanie drażniące i pozostawia na skórze trudne do usunięcia plamy. Należy zachować ostrożność jak zawsze przy kontakcie z chemikaliami.
Mając gotowe fotoanodę, katodę oraz elektrolit możemy przystąpić do zestawienia całego ogniwa (według Rys.1), tzn. złożyć obie płytki szklane razem stronami przewodzącymi do wewnątrz. Wzbogacona barwnikiem warstwa tlenku tytanu(IV) musi się kontaktować z warstwą węglową. Następnie za pomocą pipety pasteurowskiej należy wsączyć między płytki niewielką ilość elektrolitu – jest to dosyć łatwe dzięki zjawiskom kapilarnym. Uzyskany w ten sposób warstwowy układ płytek – elektrod wygodnie jest spiąć razem (ostrożnie, tak by nie uszkodzić warstw aktywnych) spinaczami biurowymi. Do wystających na boki odkrytych fragmentów szkła przewodzącego podłącza się przewody, np. za pomocą zacisków krokodylkowych. Całość można zobaczyć na Fot.16.
Ogniwo należy oświetlać oczywiście od strony fotoanody.
Trwałość ogniwa jest ograniczona, głównie ze względu na wykorzystanie ciekłego elektrolitu. Po przeprowadzeniu doświadczeń można rozdzielić elektrody, wypłukać elektrolit i pod warunkiem nieuszkodzenia warstw aktywnych wykorzystać je ponownie.
Trzeba przyznać, że tym razem dla osiągnięcia efektu musieliśmy się dosyć dużo napracować. Czy jednak zbudowane w ten sposób fotoogniwo rzeczywiście działa, tj. przekształca energię świetlną w elektryczną? Aby się o tym przekonać musimy wykonać odpowiednie pomiary.
Chwila prawdy, czyli pomiary
By sprawdzić, czy zbudowane fotoogniwo pracuje należy je podłączyć do woltomierza, najlepiej pracującego na zakresie miliwoltów.
Jak widać, nawet przy braku dostępu światła do ogniwa na jego elektrodach występuje niewielkie napięcie rzędu pojedynczych miliwoltów (Fot.17A). Polaryzacja tego napięcia jest odwrotna do spodziewanej. Można przypuszczać, że napięcie to jest generowane na drodze elektrochemicznej.
Po odsłonięciu fotoogniwa można zauważyć, że przy dostępie światła zaczyna ono wytwarzać napięcie elektryczne, które w tym przypadku wynosi nieco ponad 100mV przy obciążeniu jedynie woltomierzem (Fot.17B). Zakrywając i odsłaniając fotoogniwo można się przekonać, że wytwarzanie energii elektrycznej jest rzeczywiście uzależnione od dostępu światła.
Pomiar natężenia prądu wytwarzanego przez ogniwo mikroamperomierzem ujawnia, że przy braku dostępu światła prąd praktycznie nie płynie, a przynajmniej jest niemierzalny nawet za zakresie mikroamperów (Fot.18A). Po wystawieniu na światło natężenie prądu wyniosło w tym przypadku nieco ponad 30μA.
Powyższe wyniki zostały uzyskane po wystawieniu ogniwa na światło sztuczne. Najlepsze wyniki otrzymano po wystawieniu na bezpośrednie światło słoneczne – napięcie dochodziło wtedy do 400mV przy natężeniu około 1000μA (1mA).
Z doświadczeń wynika, że zbudowane w opisany sposób ogniwo z pewnością działa. Potwierdza to, że możliwe jest wykonanie w domowych warunkach fotoogniwa uczulanego barwnikiem.
Wyjaśnienie
Aby wyjaśnić sposób, w jaki działa przedstawione ogniwo warto zapoznać się najpierw ze schematem ukazującym w powiększeniu strukturę ogniwa oraz polaryzację jego elektrod (Rys.2).
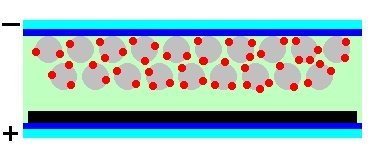
Jak widać, w czasie dzisiejszych doświadczeń zbudowaliśmy całkiem skomplikowane urządzenie, którego grubość wyniosła jednak tylko ułamek milimetra.
Cząsteczki barwnika zostały trwale związane z powierzchnią cząstek porowatej warstwy spieczonego tlenku tytanu(IV) za pomocą wiązań chemicznych różnego typu.
W produkcji fotoogniw barwnikowych można wykorzystać różnorodne barwniki naturalne, np. pochodzące z malin antocyjany. Z moich doświadczeń wynika, że zadowalające rezultaty można uzyskać także przy użyciu antocyjanów pochodzących z jeżyn, a według wielu doniesień doskonale nadają się w tym celu owoce mangostanu Garcinia [7]. Jeśli chodzi o barwniki inne niż antocyjany, to z powodzeniem udało się zastosować karotenoidy i chlorofile. Z drugiej strony, bardzo wydajne są ogniwa tego typu oparte na barwnikach syntetycznych, np. na związkach kompleksowych rutenu Ru.
Aby zrozumieć procesy prowadzące do powstania energii elektrycznej w omawianym fotoogniwie spójrzmy na Rys.3.
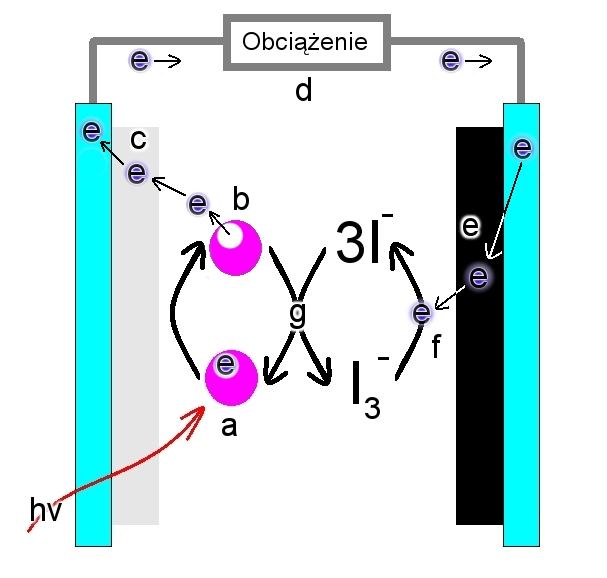
Na fotoanodzie wykorzystujemy zdolność barwnika do pochłonięcia kwantu promieniowania elektromagnetycznego o energii hν, gdzie h to stała Plancka, zaś ν jest równe częstotliwości tego promieniowania (Rys.3a). W rezultacie cząsteczka barwnika B pozostająca wcześniej w stanie podstawowym ulega wzbudzeniu do stanu o wyższej energii, dzięki czemu uwalnia ona elektron (Rys.3b). Uwolniony elektron może zostać efektywnie przeniesiony do pasma przewodnictwa tlenku tytanu(IV) jako półprzewodnika, ponieważ energia wzbudzenia barwnika jest wyższa niż krawędź tego pasma (Rys.3c). Elektrony są dalej transportowane do podłoża przewodzącego ITO pełniącego funkcję ich kolektora, a następnie za pomocą przewodnika płyną poprzez odbiornik, co może być wykorzystane do wykonania efektywnej pracy (Rys.3d).
Zauważmy jednak, że wzbudzone cząsteczki barwnika ulegają dezelektronacji czyli utlenieniu – właśnie w ten sposób uzyskaliśmy przecież przepływ elektronów. Barwnik natomiast w postaci utlenionej Box+ jest już nieprzydatny jako narzędzie fotokonwersji. Aby go przywrócić do formy zredukowanej są wykorzystywane elektrony dopływające poprzez obciążenie do katody. Proces ten nie zachodzi jednak bezpośrednio, lecz dzięki elektrolitowi, w którym występują zarówno jony jodkowe I-, jak i trójjodkowe I3-. Dostarczone do katody elektrony (Rys.3e), dzięki katalitycznemu działaniu warstwy węglowej służą do redukcji trójjodków do jodków według równania reakcji (Rys.3f):
Jony jodkowe redukują następnie utlenioną formę barwnika Box+ do zredukowanej B, same ulegając przy tym ponownemu utlenieniu do trójjodków (Rys.3g):
Zredukowana cząsteczka barwnika B jest gotowa na przyjęcie kolejnego kwantu promieniowania świetlnego – tym samym cały cykl się zamyka.
Udało się nam więc przekształcić energię wzbudzenia barwnika światłem słonecznym w użyteczną energię elektryczną. Zauważmy, że przedstawiony proces w swoich założeniach jest podobny do fosforylacji fotosyntetycznej zachodzącej w tzw. fazie jasnej fotosyntezy. W przypadku roślin energia wzbudzenia barwników z grupy chlorofili służy do wytworzenia gradientu stężenia jonów wodorowych H+ w poprzek błony biologicznej. Gradient ten nazywany jest siłą protonomotoryczną i jest wykorzystywany przez enzym syntazę ATP do produkcji adenozyno-5′-trifosforanu będącego głównym źródłem energii dla procesów życiowych [8].
O ile fotoogniwa barwnikowe jak na razie ustępują tradycyjnym ogniwom krzemowym pod względem wydajności i możliwości komercyjnego wykorzystania, to wydają się mieć one wiele zalet. Z punktu widzenia ekologii największą jest to, że można je produkować bez wykorzystania trudno dostępnych i szkodliwych surowców – zanieczyszczenie środowiska jest więc mniejsze. Po opracowaniu konstrukcji możliwych do wdrożenia w wielkoskalowej produkcji ich cena powinna być stosunkowo niska. Dodatkowo, przy zastosowaniu cienkiej warstwy innych katalizatorów niż węgiel ogniwa te mogą być przezroczyste, a w zależności od wykorzystanego barwnika można im nadawać różne barwy. Można więc wyobrazić sobie ich wykorzystanie w produkcji… barwnych szyb wytwarzających elektryczność.
Myślę, że zbudowanie własnego fotoogniwa daje wiele satysfakcji, nawet jeśli jego sprawność jest niewielka. Mechanizm działania fotoogniwa barwnikowego jest wspaniałym przykładem naśladownictwa procesów zachodzących w naturze, a nie ma lepszej drogi żeby zapoznać się z tymi zagadnieniami niż poprzez własne doświadczenia.
Literatura:
- [1] Annual Solar Irradiance, Intermittency and Annual Variations, w serwisie: http://www.greenrhinoenergy.com, dostępne online: http://www.greenrhinoenergy.com/solar/radiation/empiricalevidence.php, [dostęp: 19.04.2017] powrót
- [2] Burschka J., Pellet N., Moon S.-J., Humphry-Baker R. i inni, Sequential deposition as a route to high-performance perovskite-sensitized solar cells, Nature, 499 (7458), 2013, str. 316-319 powrót
- [3] Kim H., Gilmore C., Pique A., Horwitz J., Mattoussi H., Murata H., Kafafi, Z., Chrisey D., Electrical, optical, and structural properties of indium–tin–oxide thin films for organic light-emitting devices, Journal of Applied Physics, 86 (11), 1999, str. 6451 powrót
- [4] Hassa R. (red.), Mrzigod J. (red.), Nowakowski J. (red.), Podręczny słownik chemiczny, Wydawnictwo Videograf II, Katowice, 2004, str. 55 powrót
- [5] Smith Y. R., Crone E., Subramanian V., A Simple Photocell To Demonstrate Solar Energy Using Benign Household Ingredients, Journal of Chemical Education, 90 (10), 2013, str. 1358-1361 powrót
- [6] Smestad G. P., Grätzel M., Demonstrating Electron Transfer and Nanotechnology: A Natural Dye–Sensitized Nanocrystalline Energy Converter, Journal of Chemical Education, 6 (75), 1998 powrót
- [7] Siuzdak K., Energia elektryczna z kwiatów – ogniwa fotowoltaiczne wykorzystujące naturalne barwniki, Fizyka w Szkole, 1, 2014, str. 29-34 powrót
- [8] Ferreira K. N., Iverson T. M., Maghlaoui K., Barber J., Iwata S., Architecture of the photosynthetic oxygen-evolving center, Science, 5665 (303), 2004, str. 1831-1838 powrót
Wszystkie fotografie wykonane przez autora
Uzupełnienie autora
Poniżej przedstawiam film przybliżający temat opisywanego ogniwa.
Marek Ples