Heptatlenek i burza w probówce
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (3/2020):

W chemii reaktywnością nazywamy zdolność związków i pierwiastków chemicznych do brania udziału w reakcjach z innymi substancjami. Cechę tę omawia się zwykle w odniesieniu do ogólnej zdolności określonego indywiduum chemicznego do reagowania z pewną grupą innych chemikaliów.
Już na pierwszych etapach edukacji chemicznej uczymy się - np. w kontekście budowy Układu Okresowego oraz prawa okresowości Mendelejewa, mówiącego, że właściwości pierwiastków chemicznych uporządkowanych zgodnie ze wzrastająca liczbą atomową powtarzają się periodycznie - o tym, że reaktywność litowców i w mniejszym stopniu także berylowców jest na ogół dużo większa niż innych metali. Często wykazuje się to na przykładzie sodu Na, który reagując z wodą rozgrzewa się aż do temperatury topnienia, a nierzadko ulega nawet zapłonowi. Można to zobaczyć na Fot.1 – wyraźnie widoczna jest żółta barwa charakterystyczna dla obecności wspomnianego metalu, a malinowe zabarwienie roztworu wynika z obecności fenoloftaleiny w środowisku zasadowym wytworzonym przez powstający wodorotlenek sodu NaOH.
Z drugiej strony, znamy tzw. gazy szlachetne, czyli pierwiastki 18 grupy układu okresowego, które rzadko i jedynie w bardzo specyficznych warunkach tworzą trwałe połączenia chemiczne. Ich przykładem może być neon Ne, pięknie świecący w polu elektrycznym (Fot.2).
W dzisiejszym opracowaniu chciałbym przybliżyć Szanownemu Czytelnikowi pewną łatwą do otrzymania, a jednocześnie ciekawą z powodu swojej niestabilności i wysokiej reaktywności chemicznej substancję, przy użyciu której możemy przeprowadzić wiele bardzo efektownych doświadczeń. Będzie to jeden z tlenków manganu Mn.
Heptatlenek dimanganu
Tlenek manganu(VII) o wzorze sumarycznym Mn2O7 (nazywany także heptatlenkiem dimanganu) to nieorganiczny związek chemiczny z grupy tlenków, w którym mangan występuje na VII stopniu utlenienia. Po raz pierwszy opisano go w 1860 roku. W stanie stałym ma postać zielonych kryształów, rozpuszczalnych w tetrachlorometanie CCl4. Sublimuje już w temperaturze −10°C [1] [2].
Długości wiązań pomiędzy atomem manganu i skrajnymi atomami tlenu są równe 1,59Å, natomiast pomiędzy atomem manganu i atomem tlenu w pozycji mostkowej – 1,77Å. Wartość kąta mangan−tlen−mangan wynosi 120,7°. Interesującą strukturę cząsteczki tego związku przedstawia Rys.1.
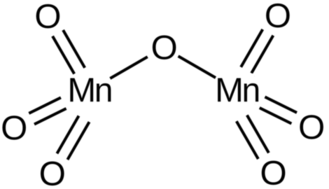
Struktura heptatlenku dimanganu jest analogiczna do budowy związków zawierających aniony np. difosforanowe P2O4-7 i dichromianowe Cr2O2-7, a także do heptatlenku dichloru Cl2O7.
Zanim przystąpimy do jakiegokolwiek bliższego zaznajomienia z omawianym związkiem, muszę ostrzec wszystkich Czytelników. Związki manganu są toksyczne, a potrzebny w doświadczeniach stężony kwas ma właściwości żrące. Zarówno tlenek manganu(VII), jak i wykorzystywany do jego produkcji manganian(VII) potasu są silnymi utleniaczami – ich mieszaniny z jakimikolwiek reduktorami mogą mieć właściwości samozapalne oraz wybuchowe (tlenek jest dużo bardziej niestabilny i niebezpieczny). Konieczne jest wdrożenie środków ochrony przeciwpożarowej. Powstające w czasie reakcji produkty lotne nie powinny być wdychane, dlatego doświadczenia trzeba prowadzić pod sprawnie działającym wyciągiem lub na zewnątrz. Wszystkie substancje stałe, a także naczynia powinny zostać dokładnie wysuszone przed doświadczeniami. Pozostałości po eksperymentach należy natychmiast unieszkodliwić w opisany sposób, a także korzystać z odpowiednich środków ochrony osobistej! Niedbałość może być tutaj bardzo niebezpieczna!
Otrzymanie próbki tlenku manganu(VII) nie jest trudne. W tym celu trzeba umieścić na szkiełku zegarkowym niewielką ilość (zdecydowanie poniżej 1g) manganianu(VII) potasu KMnO4, nazywanego też często nadmanganianem (Fot.3).
Związek ten z racji swoich właściwości odkażających znajduje zastosowanie w lecznictwie. Nie dziwi więc fakt, że można go z łatwością kupić w aptekach. Z powodu swojej barwy bywa nazywany “fioletem”. Trzeba jednak pamiętać, że potocznie mówi się w ten sam sposób o wielu różnych substancjach - choćby o stosowanym w podobnych celach fiolecie gencjanowym. W warunkach normalnych manganian(VII) ma postać, jak zresztą zobaczyć można na fotografii, charakterystycznych kryształków o barwie ciemnofioletowej, prawie czarnej.
Chcąc otrzymać potrzebną nam substancję bezpośrednio na kryształy soli manganu(VII) należy nanieść kilka cm3 stężonego kwasu siarkowego(VI) H2SO4, tak by substancja stała mogła się w nim rozpłynąć. W efekcie uzyskujemy ciemnozieloną ciecz zawdzięczającą swą barwę obecności powstałego tlenku manganu(VII), co możemy zaobserwować na Fot.4.

Przystępując do badania cech otrzymanego związku możemy się przekonać, że jest on bardzo niestabilną substancją – ulega rozkładowi już w temperaturach zbliżonych do pokojowej, a powyżej 55°C i większych ilościach proces ten zaczyna zachodzić wręcz wybuchowo. Łatwo to sprawdzić, przykładając do próbki tlenku drut miedziany podgrzany do temperatury około 100°C, a nawet niższej (Fot.5).
Praktycznie natychmiast po wejściu ogrzanego metalu w kontakt z substancją możemy zaobserwować gwałtowny zapłon i powstanie dużej ilości brunatnego dymu. Barwa płomienia jest pomarańczowa.
Przekonaliśmy się, że nawet sam omawiany związek jest skrajnie niestabilny. Spróbujmy jednak zmieszać go z jakimś łatwopalnym materiałem, np. w postaci cieczy. Jako pierwszy polecam wypróbować aceton C3H6O, czyli powszechnie dostępny i niezbyt toksyczny keton. Doświadczenie jest łatwe do wykonania: na szkiełko zegarkowe ze świeżą porcją tlenku manganu(VII) należy upuścić z dosyć sporej wysokości dosłownie jedną kroplę acetonu (użycie większych ilości może być niebezpieczne), najlepiej za pomocą pipety pasteurowskiej (Fot.6A). Natychmiast po zetknięciu się substancji aceton ulega gwałtownemu zapłonowi, któremu może towarzyszyć efekt dźwiękowy w postaci trzasku lub syku (Fot.6B). Jednocześnie powstaje chmura znanego nam już dymu (Fot.6C).
Kolejnym, bardzo efektownym pokazem będzie zapalenie niewielkiej „pochodni” w tajemniczy - dla osób niezorientowanych - sposób. Miniaturową pochodnię łatwo jest wykonać nawijając na koniec patyczka do szaszłyków nieco naturalnej waty, będącej właściwie czystą celulozą (Fot.7).
Aby rozpalić uzyskaną pochodnię, należy watę na jej końcu delikatnie nasączyć alkoholem etylowym C2H5OH. Można w tym celu wykorzystać spirytus spożywczy lub denaturat. Pochodnię taką zbliżamy do próbki tlenku manganu(VII), uważając jednak, by nie doprowadzić do przedwczesnego kontaktu obu substancji (Fot.8A). Następnie musimy zdecydowanym, lecz szybkim ruchem dotknąć pochodnią substancji na szkiełku zegarkowym, co spowoduje gwałtowny zapłon i rozbłysk, a często także okrzyk wśród widzów (Fot.8B). Po chwili, kiedy tylko rozwieje się chmura brązowego dymu (Fot.8C), możemy zauważyć, że nasza minipochodnia się pali (Fot.8D).
Opisany pokaz można też zainscenizować inaczej. W takim przypadku na ogniotrwałej płytce ceramicznej musimy umieścić np. poskładany papierowy ręcznik nasączony etanolem. Tym razem ogień rozpalimy za pomocą bagietki grającej rolę „czarodziejskiej” różdżki – końcem bagietki musimy wcześniej oczywiście dotknąć próbki tlenku manganu(VII), tak by osadziła się na niej niewielka ilość tej substancji (Fot.9).
Po kontakcie bagietki z materiałem nasączonym alkoholem zapala się on z mniej lub bardziej wyraźnym trzaskiem (Fot.10).
Wszelkie pozostałości i mieszaniny zawierające tlenek manganu(VII) muszą zostać unieszkodliwione poprzez zalanie dużą ilością zimnej wody.
Potężna natura
Kolejnym doświadczeniem, w którym możemy wykorzystać właściwości tlenku manganu(VII), jest otrzymanie tzw. burzy w probówce. Przygotowanie pokazu jest nieco bardziej skomplikowane niż w poprzednich przypadkach, ale uzyskany efekt z pewnością zrekompensuje poczyniony nakład pracy.
Do przeprowadzenia doświadczenia potrzebujemy - podobnie zresztą jak poprzednio - stężonego kwasu siarkowego(VI), manganianu(VII) potasu i alkoholu etylowego 96%.
Bardzo ważna jest staranność. Probówka użyta w tym doświadczeniu musi być wcześniej bardzo dokładnie umyta, odtłuszczona – np. poprzez płukanie acetonem – i wysuszona. Naczynie mocujemy potem stabilnie w pozycji pionowej. Następnie za pomocą pipety pasteurowskiej wlewamy na dno kilka centymetrów sześciennych stężonego kwasu, ale tak by nie zwilżyć ścianek naczynia. Kolejną rzeczą jaką musimy zrobić jest delikatne wlanie do probówki po jej ściance podobnej ilości alkoholu etylowego. Ciecze nie mogą się przy tym wymieszać. Kwas i etanol powinny uformować dwie fazy z wyraźnie widoczną granicą pomiędzy nimi (Fot.11).
Po opisanych przygotowaniach możemy przystąpić do zainicjowania reakcji. Robimy to poprzez wrzucenie do probówki kilku (nie więcej!) maleńkich kryształków manganianu(VII) potasu.
Chwilę po dotarciu manganianu do granicy faz rozpoczyna się chemiczna burza: ciecz zmienia barwę na ciemnobrunatną, pod jej powierzchnią widzimy jasne rozbłyski, słyszalne są też charakterystyczne trzaski (Fot.12).
Reakcja jest silnie egzotermiczna. Dla bezpieczeństwa dobrze jest zanurzyć dolną część probówki na czas doświadczenia w większej zlewce z zimną wodą. Pokaz koniecznie trzeba prowadzić na niepalnej powierzchni, a cały układ reakcyjny powinien znajdować się w odpowiednim naczyniu (misce, dużym krystalizatorze) na wypadek pęknięcia probówki. Należy brać też pod uwagę ewentualność rozprysku, czy nawet wyrzucenia zawartości probówki na zewnątrz, co może być bardzo niebezpieczne!
Dużo uwagi należy poświęcić bezpiecznemu usunięciu pozostałości po doświadczeniu. Mieszaninę poreakcyjną najlepiej ostrożnie wlać szybkim ruchem do dużej ilości zimnej wody, zachowując wspomniane wcześniej środki bezpieczeństwa.
Wyjaśnienie
Przeprowadzoną przez nas reakcję otrzymywania tlenku manganu(VII) opisuje się zwykle sumarycznym równaniem:
Opisany proces w rzeczywistości jest dwuetapowy: początkowo powstaje nietrwały kwas nadmanganowy HMnO4, który w warunkach reakcji samorzutnie traci wodę, przechodząc w tlenek manganu(VII), który należy traktować jako jego bezwodnik.
Jak już wspominałem, powstający tlenek manganu(VII) jest bardzo nietrwałym związkiem i jednocześnie silnym utleniaczem. Związek ten rozkłada się do tlenku manganu(IV) MnO2 (dawniej nazywanego braunsztynem) i tlenu. Brązowe dymy powstające w dużych ilościach w czasie reakcji są utworzone właśnie z niewielkich cząstek niższego tlenku. Interesujące jest, że wolny tlen powstaje tutaj nie tylko w postaci normalnie występujących cząsteczek dwuatomowych O2, ale także jako silnie reaktywny trójatomowy ozon O3 [3].
Tlenek manganu(VII) gwałtownie utlenia wiele substancji organicznych, takich jak aceton i alkohole. W przypadku doświadczenia z burzą w probówce, opadające przez warstwę alkoholu kryształki manganianu(VII) potasu reagują z kwasem, przez co powstają niewielkie ilości omawianego tlenku, który gwałtownie reaguje z alkoholem. W rzeczywistości dochodzi tutaj do maleńkich eksplozji w obrębie mieszaniny reakcyjnej, co obserwujemy jako rozbłyski i trzaski.
Dawniej samozapalne właściwości mieszanin zawierających tlenek manganu(VII) tłumaczono powstawaniem tlenu atomowego in statu nascendi. Dziś wiemy jednak, że to sam tlenek manganu(VII) jest głównym utleniaczem w opisanych reakcjach.
- [1] Lux H., Manganese(VII) Oxide, w: Brauer G., Handbook of Preparative Inorganic Chemistry (2nd ed.), Academic Press, Nowy Jork, 1963, str. 1459-1460 powrót
- [2] Simon A., Dronskowski R., Krebs B., Hettich B., The Crystal Structure of M2O7, Angewandte Chemie (International Edition in English), 26, 1987, str. 139-140 powrót
- [3] Holleman A.F., Wiberg E., Inorganic Chemistry, Academic Press, San Diego, 2001 powrót
Wszystkie fotografie i rysunki zostały wykonane przez autora
Marek Ples











