Kolor temperatury
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (2/2018):

Maria Pawlikowska-Jasnorzewska, polska poetka dwudziestolecia międzywojennego, w swoim wierszu Barwy skarżyła się:
"O, jakże się w białości mojej bieli męczę -
chcę barwą być – a któż mnie rozbije na tęczę?"
Pozostawiając jednak chwilowo kwestie liryki na boku, zastanówmy się czym właściwie jest barwa lub kolor?
Barwa, nazywana też kolorem jest wrażeniem psychicznym powstającym w mózgu człowieka i zwierząt pod wpływem odbioru promieniowania elektromagnetycznego z zakresu widzialnego. Wrażenie barwy zależy w głównej mierze od składu widmowego promieniowania świetlnego, a nieco mniej od ilości dostarczonej w ten sposób energii. Trzeba jednak pamiętać, że odbiór barwy przez obserwatora jest subiektywny, więc duże znaczenie ma obecność innych barw w polu widzenia obserwatora, jego samopoczucie, a nawet doświadczenie w posługiwaniu się zmysłem wzroku [1].
Istnieje dziedzina nauki zajmująca się badaniem wrażeń barwnych oraz sposobem ich odbioru - jest to tzw. teoria koloru. Dziedzina ta operuje w obrębie zagadnień nie tylko fizyki i biologii, ale także psychologii.
W powszechnym mniemaniu jedną z najbardziej „kolorowych” dziedzin nauki jest chemia. Nie zaskakuje to, ponieważ chemia bada przecież naturę i właściwości substancji, a zwłaszcza przemiany zachodzące pomiędzy nimi. Wiemy dziś, że wspomniane przemiany wynikają z praw, według których atomy łączą się poprzez wiązania chemiczne w mniej lub bardziej trwałe związki, a także rozpadają się na inne. Chemia bada też, w jaki sposób właściwości substancji wynikają bezpośrednio z ich struktury molekularnej.
Na barwę związków chemicznych i pierwiastków wpływ ma wiele zróżnicowanych czynników, m.in. rodzaj substancji, jej stan skupienia, postać alotropowa, wykorzystany rozpuszczalnik. Barwę niektórych substancji może modyfikować temperatura, jako wielkość związana ze średnią energią kinetyczną ruchu i drgań wszystkich cząstek tworzących układ [2].
Przekształcenia barwy podczas zmian temperatury są przykładem termochromizmu, należącego do klasy zjawisk chromotropowych (chromotropizmów) [3].
Myślę, że wspomniane zjawiska są interesujące, a wykonanie demonstrujących je doświadczeń nie nastręcza trudności – dalsza lektura artykułu powinna o tym przekonać Szanownego Czytelnika.
Doświadczenia i wyjaśnienia
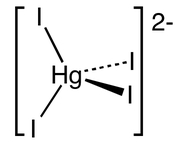
Jednymi z najczęściej omawianych związków termochromowych są niektóre sole zawierające kompleksowy jon tetrajodortęcianowy(II) o wzorze [HgI4]2-. Jego wzór strukturalny można zobaczyć na Rys.1.
Warto wspomnieć też, że tetrajodortęcian(II) potasu K2[HgI4] jest znany pod nazwą odczynnika Nesslera i służy do wykrywania jonów amonowych NH4+. Nie wykazuje on jednak poszukiwanych przez nas wyraźnych właściwości termochromowych. Taką cechę ma jednak tetrajodortęcian(II) miedzi(I) Cu2[HgI4].
Uwaga praktyczna: zdecydowana większość związków rtęci Hg to substancje bardzo szkodliwe i niebezpieczne. Odnosi się to także do związków wykorzystywanych w opisywanych tutaj eksperymentach. Już podczas projektowania doświadczeń trzeba koniecznie zastanowić się nad bezpiecznymi sposobami unieszkodliwienia pozostałości. Trzeba zachować wszelkie środki ostrożności i używać środków ochrony osobistej.
Do przygotowania związku termochromowego potrzebujemy [4]:
- chlorek rtęci(II) HgCl2,
- jodek potasu KI,
- pentahydrat siarczanu(VI) miedzi(II) CuSO4 · 5H2O,
- disiarczan(IV) potasu K2S2O5.
Po pierwsze, musimy przygotować roztwór 1,7g chlorku rtęci(II) w 12cm3 wody destylowanej. W tej samej ilości wody należy sporządzić osobno roztwór 4,2g jodku potasu.
Ciągle mieszając trzeba dodawać powoli roztwór jodku do roztworu soli rtęci. Początkowo wydzielają się przy tym duże ilości jodku rtęci(II) HgI2 powstającego w myśl równania reakcji:
Przy dalszym dodawaniu roztworu czerwony osad jodku rtęci(II) ulega roztworzeniu na skutek obecności nadmiaru jonów jodkowych I-:
Po całkowitym połączeniu obu cieczy dysponujemy więc klarownym roztworem zawierającym m.in. jony tetrajodortęcianowe(II). Należy do niego – ciągle intensywnie mieszając – dodać powoli roztwór 6g pentahydratu siarczanu(VI) miedzi(II) w jak najmniejszej ilości wody. Zachodzi wtedy reakcja:
Powstaje czerwony osad interesującego nas tetrajodortęcianu(II) miedzi(I). Niestety jednocześnie wytrącają się duże ilości praktycznie nierozpuszczalnego w wodzie pierwiastkowego jodu I2 – usuwamy go wkraplając powoli do mieszaniny roztwór disiarczanu(IV) potasu. Dodajemy go w ilości koniecznej dla zaniku barwy charakterystycznej dla jodu. Czerwony osad związku kompleksowego możemy odsączyć, kilkukrotnie przemyć wodą, następnie acetonem, po czym wysuszyć (Fot.1).
W produkcji tetrajodortęcianu można też wykorzystać świeżo przygotowany chlorek miedzi(I) CuCl, lecz z reguły siarczan(VI) jest łatwiejszy do zdobycia [5].
Zachowując odpowiednie środki ostrożności trzeba nanieść szczyptę suchej substancji na kartkę zwykłego papieru, a następnie rozetrzeć. Otrzymaną czerwoną plamę radzę w ramach bezpieczeństwa pokryć warstwą szerokiej przezroczystej taśmy klejącej (Fot.2). Uniemożliwi to odrywanie się podczas manipulacji z tak spreparowanym papierem drobinek toksycznej substancji.
Powstały w ten sposób arkusik papieru można przykleić taśmą biurową np. do bocznej, zewnętrznej powierzchni laboratoryjnej zlewki (Fot.3).
Do tak przygotowanej zlewki trzeba wlać gorącej, prawie wrzącej wody. Szczególnie malowniczy efekt uzyska się, jeśli poziom wody sięgnie mniej więcej do połowy wysokości barwnego arkusza lub nieco wyżej (Fot.4).
Jak widać, wzrost temperatury naczynia pociągnął za sobą zmianę barwy tetrajodortęcianu(II) miedzi(I) na prawie czarną. Zjawisko zachodzi w temperaturze około 70°C. Zauważmy jak ostra jest granica między barwami. Proces jest całkowicie odwracalny – po ochłodzeniu powraca barwa czerwona.
Właściwości termochromowe wykazuje też tetrajodortęcian(II) srebra, który można uzyskać podobną metodą. Zmiany barwy w jego przypadku są jednak zdecydowanie mniej kontrastowe. Nie można tu nie wspomnieć, że powstający przejściowo w opisywanej syntezie jodek rtęci(II) także pozwala na zapoznanie się ze zjawiskiem termochromizmu – w temperaturze pokojowej jest czerwony, zaś po ogrzaniu żółty [6].
W razie chęci przechowania termochromowych związków rtęci do przyszłych doświadczeń zalecam zatopienie ich w szklanych ampułkach. Umożliwia to demonstracje ich ciekawych właściwości bez konieczności naruszania naczyń i wchodzenia w bezpośredni kontakt z tymi niezbyt przyjemnymi substancjami.
Doświadczenia ze związkami rtęci są bardzo efektowne i pouczające. Zrozumiała jest jednak niechęć do wykorzystywania tak toksycznych substancji. Dlatego w dalszej części artykułu opiszę wykonanie podobnych, ale mniej niebezpiecznych doświadczeń.
Pierwszą alternatywą jest wykorzystanie jodku ołowiu(II) PbI2. Można go w łatwy sposób otrzymać w reakcji strąceniowej. Potrzebujemy więc:
- azotan(V) ołowiu(II) Pb(NO3)2,
- jodek potasu KI.
Azotan(V) można zastąpić inną rozpuszczalną solą tego metalu, np. octanem ołowiu(II) o wzorze (CH3COO)2Pb. Pamiętać trzeba, że chociaż zwykle mniej niebezpieczne od podobnych związków rtęci, to połączenia chemiczne zawierające w swej strukturze ołów są także toksyczne.
Chcąc otrzymać potrzebny jodek wystarczy zmieszać roztwory obu wspomnianych substancji. Natychmiast powstają duże ilości jaskrawożółtego osadu (Fot.5).
Reakcję tę można oczywiście opisać równaniem:
Reakcja ta jest wykorzystywana jako czuła próba na obecność zarówno jonów jodkowych I-, jak i ołowiowych Pb2+.
Osad trzeba oczywiście przynajmniej kilkukrotnie przemyć wodą, odsączyć i wysuszyć. Ma on postać żółtego, ciężkiego proszku (Fot.6).
By przekonać się o termochromowych właściwościach otrzymanej soli ołowiu najlepiej wsypać nieco tej substancji do probówki (Fot.7A).
Próbówkę należy następnie delikatnie ogrzewać palnikiem. Bardziej odpowiedni wydaje się w tym przypadku raczej palnik spirytusowy niż gazowy, ponieważ w zbyt wysokiej temperaturze substancja ulegnie po prostu stopieniu. Tak czy inaczej już po chwili ogrzewania barwa omawianego jodku zmienia się z żółtej na czerwono-pomarańczową (Fot.7B). Po ochłodzeniu substancja staje się na powrót jaskrawożółta.
W przypadku wspomnianych związków rtęci i ołowiu zmiany barwy były spowodowane faktem, że substancje te mogą istnieć w różnych formach o odmiennych właściwościach fizycznych (w tym przypadku m.in. o innej barwie). Formy te są termodynamicznie stabilne w różnych temperaturach. Tak więc przy zmianach temperatury możemy obserwować przekształcanie się form stabilnych w temperaturze pokojowej w formy stabilne w temperaturze podwyższonej i vice versa.
Czy istnieją jednak jakieś jeszcze bezpieczniejsze w wykorzystaniu związki termochromowe? Okazuje się, że tak. Jednym z nich jest tlenek cynku ZnO, nazywany często bielą cynkową [7].
Tlenek cynku stosowany jest jako dodatek do farb i lakierów, w kosmetyce, ceramice oraz jako wypełniacz w produkcji gumy, kauczuku i tworzyw sztucznych. Został wprowadzony w malarstwie jako pigment w XVIII wieku. Wykorzystuje się go także jako proszek daktyloskopijny. Tlenek cynku jest stosowany w lecznictwie z racji delikatnego działania antybakteryjnego – ma pozytywny wpływ na proces gojenia się ran. Jest stosowany jako składnik różnego rodzaju maści i zasypek leczniczych.
W normalnych warunkach tlenek cynku jest biały (Fot.8).
Teraz trzeba tlenek cynku podgrzać do dosyć wysokiej temperatury – w tym przypadku z pewnością palnik spirytusowy będzie niewystarczający. Konieczność osiągnięcia temperatury powyżej 400°C wymaga użycia palnika gazowego.
Po ogrzaniu do odpowiedniej temperatury tlenek staje się wyraźnie żółty (Fot.9). W literaturze często przyjmuje się, że temperatura zmiany barwy wynosi tutaj około 425°C.
Także i w tym przypadku zmiana barwy jest całkowicie odwracalna i można dla danej próbki substancji przeprowadzać ją wielokrotnie. Mechanizm zjawiska jest jednak odmienny niż dla soli rtęci i ołowiu. Wiemy, że wraz ze wzrostem temperatury wzrasta intensywność drgań cząstek uporządkowanych w sieci krystalicznej. W krystalicznym tlenku cynku - przy odpowiednio wysokiej temperaturze - powoduje to powstanie tzw. centrów barwnych (centrów F). Są to defekty sieci krystalicznej, polegające na tym, że część miejsc normalnie zajmowanych przez jon ujemny zostaje obsadzone przez jeden lub więcej niesparowanych elektronów. Fizycznie oznacza to, iż w procesie ogrzewania z kryształu ZnO „wygotowywany” jest tlen, pozostawiający w sieci krystalicznej elektrony z oryginalnych anionów tlenkowych O2- . Nie jest przy tym wykluczone, że odpowiednia część jonów Zn2+ ulega wtedy redukcji do stopnia utlenienia +1. Powstawanie takich defektów pociąga za sobą zmianę zdolności absorpcji określonych długości promieniowania z zakresu widzialnego, a więc i barwy światła odbitego [8].
Inny jest mechanizm zmiany barwy hydratów (soli uwodnionych) pod wpływem ogrzewania. By przeanalizować to zagadnienie posłużymy się przykładem już wykorzystywanego przez nas pentahydratu siarczanu(VI) miedzi(II). W normalnych warunkach substancja ta ma postać kryształów o pięknej niebieskiej barwie (Fot.10).
W wyniku ogrzewania powyżej temperatury 197°C w wyglądzie związku zachodzi dosyć drastyczna zmiana – kryształy rozsypują się na śnieżnobiały, bezpostaciowy proszek (Fot.11)
Tym razem jednak po ochłodzeniu nie powraca niebieska barwa związku. Jaki jest powód takiego stanu rzeczy?
By odpowiedzieć na to pytanie należy zważyć niebieski związek, a następnie – dosyć szybko po wyprażeniu, ale już po ostygnięciu do temperatury pokojowej – także powstałą z niego białą substancję. W moim przypadku wykorzystałem 10,1g niebieskiej substancji, z której otrzymałem 6,7g białego produktu. Oznacza to całkiem spory, bo ponad 36% ubytek masy! Czyżby więc w przypadku tej substancji podgrzanie nie tylko spowodowało zmianę barwy, ale także naruszenie prawa zachowania masy? Może tak się wydawać, ale prawda jest oczywiście inna.
Okazuje się, że podczas ogrzewania hydratów w odpowiednio wysokiej temperaturze woda może uwolnić się z wiążącej ją sieci krystalicznej. W przypadku siarczanu(VI) miedzi(II) właśnie w temperaturze 197°C uwolniona zostaje cała związana woda. Opisuje to następujące równanie reakcji:
Woda w takich warunkach opuszcza układ w postaci pary wodnej. Przyjmując, że masy molowe formy uwodnionej i bezwodnej wynoszą odpowiednio 249,61g/mol i 159,61g/mol można łatwo obliczyć, że z 10,1g hydratu powinno powstać około 6,5g produktu. Wynik ten jest zbliżony do otrzymanego eksperymentalnie – wartość rzeczywista była nieco większa od wyliczonej teoretycznie najprawdopodobniej z powodu niecałkowitego usunięcia wody lub ponownego jej pochłonięcia z powietrza przez ważeniem.
Tak czy inaczej z pewnością możemy stąd wysnuć wniosek, że bezpośrednim powodem zmiany barwy było usunięcie z sieci krystalicznej uwięzionych w jej strukturze cząsteczek wody. Jednak ogrzanie było tutaj konieczne, ponieważ poniżej temperatury 197°C bardziej stabilna termodynamicznie jest forma uwodniona. Można więc powiedzieć, że zmiana barwy jest uzależniona od temperatury.
Dodatkowym potwierdzeniem opisanych faktów może być kolejne proste doświadczenie. Do probówki należy wsypać nieco ochłodzonej do temperatury pokojowej bezwodnej (białej) formy siarczanu (Fot.12A), a następnie dodać do niej kilka kropli wody. Barwa biała zostaje natychmiast zajęta przez niebieską (Fot.12B). Proces ten jest silnie egzotermiczny, o czym można się przekonać dotykając probówkę.
Kolejną substancją o podobnych właściwościach jest chlorek kobaltu(II) CoCl2. Bezwodna postać tej substancji jest intensywnie niebieska, kryształy jej dihydratu CoCl2 · 2H2O są różowe, zaś heksahydratu ciemnoczerwone CoCl2 · 6H2O (Fot.13)
Przygotujmy niezbyt stężony roztwór wspomnianej substancji. Ma on różową barwę (Fot.14).
Roztworu tego można użyć jako atramentu sympatycznego. Wystarczy nim nakreślić jakieś symbole, najlepiej na bladoróżowym papierze. Tak powstałe znaki są całkowicie niewidoczne po wyschnięciu (Fot.15).
Łatwo się domyślić, że sposobem na uwidocznienie atramentu jest delikatne podgrzanie papieru, np. poprzez prasowanie go żelazkiem (Fot.16).
Przestawione tu zmiany barwy tłumaczy się często prostym przyłączaniem wody, ale dokładniejsze opracowania wskazują, że są one spowodowane przesuwaniem się stanu równowagi pomiędzy różnymi jonami kompleksowymi:
Barwę niebieską wykazuje tu kompleks chlorkowy, zaś czerwono-różową akwakompleks [9]. Reakcja zachodząca w prawo wiąże się z wydzieleniem energii na sposób ciepła. Dzięki temu ogrzewanie powoduje przesunięcie równowagi w kierunku tworzenia niebieskiego produktu, zaś ochładzanie w kierunku czerwonego. Można się o tym przekonać wykonując ciekawe doświadczenie.
Należy przygotować bardziej stężony niż poprzednio roztwór chlorku kobaltu, a następnie dodać do niego tyle chlorku sodu NaCl (soli kuchennej), by otrzymać roztwór nasycony. Na dnie naczynia może pozostać nieco nierozpuszczonej soli sodu (Fot.17).
Dodatek chlorku sodu pełni bardzo ważną rolę. Otóż w roztworze wodnym w normalnych warunkach za pomocą ogrzewania nie jest możliwe przesunięcie stanu równowagi opisanej uprzednio reakcji w stronę kompleksu chlorkowego na tyle, by można było zaobserwować jego niebieską barwę. Dodatek jonów chlorkowych Cl- pochodzących z soli sodu przesuwa tę równowagę jednak także w kierunku produktu niebieskiego. Połączenie obu efektów pozwala zaobserwować opisywane zjawisko.
Przygotowany uprzednio roztwór jest różowo-czerwony w temperaturze pokojowej (Fot.18A). W czasie ogrzewania barwa w sposób płynny przechodzi w granatowo-niebieską (Fot.18B). Przy ochładzaniu można zaobserwować odwrotne przejścia barwne [10]. Wystarczy wykonać barwną skalę porównawczą i ciekły chemiczny termometr jest gotowy!
Przypomnijmy sobie kobaltowy atrament sympatyczny (vide Fot.15 i 16). Wiemy już, że poza wrażliwością na temperaturę powinien on także być czuły na zmiany wilgotności powietrza – za sprawą higroskopijności samego chlorku kobaltu(II), a także celulozy wchodzącej w skład papieru. Dosyć łatwo to sprawdzić zamykając szczelnie papier z niewidocznym symbolem w eksykatorze lub innym naczyniu zawierającym środek suszący, np. aktywowane sita molekularne 4Å (Fot.19).
Z racji bardzo silnego pochłaniania wilgoci przez środek suszący już po niezbyt długim czasie można zaobserwować powstanie niebieskiego zabarwienia nawet w temperaturze pokojowej (Fot.20).
Jak widać, pasek papieru zaimpregnowany lub pokryty chlorkiem kobaltu(II) może pełnić rolę swoistego higrometru.
Zauważmy, że w termochromii i innych podobnych przypadkach dochodzi do zmiany barwy światła odbitego od danej substancji. Istnieje także jakościowo inne zjawisko, nazywane fluorescencyjną termochromią. Tutaj od temperatury zależy barwa światła emitowanego przez substancję po wzbudzeniu np. światłem ultrafioletowym. Przykładem może być tutaj roztwór mleczanu etakrydyny C18H21N3O4 (rivanolu) w glicerolu C3H8O3 [11]. W temperaturze pokojowej taki roztwór bardzo intensywnie fluoryzuje jasnozielonym światłem (Fot.21A). Po ochłodzeniu zestalonym dwutlenkiem węgla CO2, czyli suchym lodem barwa fluorescencji zmienia się na wyraźnie niebiesko-zieloną (Fot.21B). Można to wyjaśniać wpływem obniżenia temperatury na redukcję strat energii zachodzących w czasie bezpromienistych przejść oscylacyjno-rotacyjnych, a co za tym idzie zmniejszeniem tzw. przesunięcia Stokesa.
Możliwości i zastosowania
Substancje termochromowe są często zaliczane do grupy tzw. materiałów inteligentnych (ang. smart materials), tzn. takich które zmieniają swoje właściwości w określony sposób w reakcji na specyficzny bodziec z otoczenia. Można więc powiedzieć, że materiał taki łączy w swojej strukturze własności czujnika i efektora, czyli układu lub elementu wykonawczego.
Istnienie substancji wykazujących zjawisko termochromizmu umożliwia wygodne – a także zdalne – monitorowanie temperatury np. wirujących elementów maszyn. W tych przypadkach pomiar innymi metodami mógłby być utrudniony. Warstwę tego rodzaju barwnika nanosi się też na niektóre naczynia kuchenne, jak choćby patelnie. Zmiana barwy wskazuje, że naczynie osiągnęło odpowiednią do przygotowania potrawy temperaturę.
Bardzo wdzięczną klasą materiałów termochromowych są niektóre rodzaje ciekłych kryształów. W oparciu o te substancje możliwe jest wytworzenie materiałów zmieniających barwę w odpowiedniej temperaturze. Na tej zasadzie oparte jest działanie np. elastycznych termometrów paskowych (Fot.22).

Termochromizm bywa także wykorzystywany w marketingu – wystarczy tu wspomnieć możliwość produkcji różnego rodzaju gadżetów zmieniających barwę. Produkuje się też odzież barwioną substancjami termochromowymi oraz różnego rodzaju farby i pigmenty.
Opisane przykłady nie wyczerpują oczywiście wszystkich zastosowań tego rodzaju substancji – możliwości są bardzo szerokie. Jest to także jeden z powodów, dla których chciałbym zachęcić Czytelnika do własnych eksperymentów.
Literatura:
- [1] Stopyra W., Widzenie barw, Okulistyka (Kompendium Okulistyki), 3 (19), 2012 powrót
- [2] Heller M., Pabjan T., Elementy filozofii przyrody, Copernicus Center Press, Kraków, 2014 powrót
- [3] Linerta W., Fukudab Y., Camarda A., Chromotropism of coordination compounds and its applications in solution, Coordination Chemistry Reviews, 218, 2001, str. 113 – 152 powrót
- [4] Pluciński T., Doświadczenia chemiczne, Wydawnictwo Adamantan, Warszawa, 1997, str. 212 powrót
- [5] Roesky H. W., Mockel K., Niezwykły świat chemii, Wydawnictwo Adamantan, Warszawa, 2001, str. 213 powrót
- [6] Sękowski S., Pierwiastki w moim laboratorium, Wydawnictwa Szkolne i Pedagogiczne, Warszawa, 1989, str. 149 powrót
- [7] Wiberg E., Holleman A. F., Holleman-Wiberg's Inorganic Chemistry, Elsevier, 2001 powrót
- [8] Schulman J. H., Compton W. D., Color Centers in Solids, Pergamon, Oxford, 1962 powrót
- [9] Pluciński T., Związki termochromowe, w serwisie: http://www.tomek.strony.ug.edu.pl/, dostępne online: http://www.tomek.strony.ug.edu.pl/termochromia, [dostęp 22.02.2018] powrót
- [10] Ples M., Ciecz zmieniająca barwę wraz z temperaturą, w serwisie: http://weirdscience.eu/, dostępne online: http://weirdscience.eu/Ciecz%20zmieniaj%C4%85ca%20barw%C4%99%20wraz%20z%20temperatur%C4%85.html, [dostęp 22.02.2018] powrót
- [11] Ples M., Fluorescencyjna termochromia - zimno, ale nie bezbarwnie, Chemia w Szkole, 4 (2017), Agencja AS Józef Szewczyk, str. 10-14 powrót
Wszystkie fotografie i rysunki zostały wykonane przez autora
Uzupełnienie autora
Jako dodatek do powyższego artykułu proponuję film ukazujący w czasie rzeczywistym zmianę barwy omawianego roztworu termochromowego:
Marek Ples





















