Krystaloluminescencja chlorku sodu
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Fizyka w szkole (3/2014):

Ciała krystaliczne są ciałami stałymi, których cząstki są ułożone w ściśle uporządkowany przestrzennie sposób. W zależności od rodzaju kryształu, jego sieć krystaliczna może składać się z cząsteczek, atomów lub jonów.
Kryształy, z racji uporządkowanej i charakterystycznej budowy, często bywają postrzegane jako symbol geometrycznego piękna. Escher, znakomity malarz i grafik holenderski, wielokrotnie to podkreślał. Pisał on, że "kryształy wyrosły w skorupie ziemskiej wiele, wiele wcześniej, zanim pojawił się człowiek. Później przyszedł dzień, kiedy człowiek pierwszy raz dostrzegł jeden z takich cudownych okruchów prawidłowej budowy. Możliwe, że odkruszył go swoim kamiennym toporem, kryształ upadł u jego stóp. Człowiek podniósł go, z uwagą obejrzał i zadumał się" [1].
Ciała krystaliczne były z pewnością inspiracją do wielu jego grafik. Można to zauważyć na poniższym drzeworycie z 1949 roku, zatytułowanym "Podwójna planetoida" (rys.1).

Kryształy wykazują wiele interesujących właściwości, jak choćby piezoelektryczność, czy termoluminescencja.
Innym ciekawym zjawiskiem jest krystaloluminescencja. Fenomen ten polega na emisji światła zachodzącej podczas wzrostu kryształu. Można to zaobserwować nawet w przypadku tak powszechnie znanej substancji, jaką jest chlorek sodu.
Pewnym problemem jest jednak to, że podobne doświadczenia, wykonywane według opisów z dawniejszych książek, bardzo często kończą się niepowodzeniem. Chociaż zjawisko po raz pierwszy opisał Ernest Bandrowski już w 1894 roku, to odpowiednie warunki, pozwalające na bardziej powtarzalne obserwacje, wskazał dopiero prawie 120 lat później Andrew J. Alexander. Przedstawione poniżej doświadczenie bazuje na opisanej przez niego procedurze [2].
Przygotowania
By przeprowadzić doświadczenie musimy posadać substancje z poniższej listy:
- kwas chlorowodorowy HCl 24%,
- chlorek sodu NaCl,
- azotan(V) srebra AgNO3,
- siarczan(VI) miedzi(II) pięciowodny CuSO4·5H2O.
Ostrzeżenie: Należy zachować ostrożność przy pracy z kwasem chlorowodorowym HCl, który jest żrący. Ulatniający się z niego chlorowodór jest drażniący, a w większych stężeniach wykazuje działanie toksyczne. Azotan(V) srebra i siarczan(VI) miedzy(II) są trujące, podobnie jak pozostałe sole metali ciężkich. Nie należy dopuścić do kontaktu soli srebra ze skórą - pod wpływem światła powstają wtedy trudne do usunięcia, czarne plamy.
Najłatwiejszy do zdobycia jest chlorek sodu NaCl, ponieważ związek ten jest wykorzystywany w prawie czystej postaci jako sól kuchenna. Chlorek ten tworzy piękne, sześcienne kryształy (fot. 1).
Handlowa sól zawiera często bardzo niewielki dodatek związków jodu, by chronić konsumentów przed chorobami, takimi jak wole. Może to być pewną przeszkodą, dlatego należy stosować produkty najtańsze, niejodowane.
Do przygotowania wszystkich roztworów należy użyć wody destylowanej! Trzeba ściśle przestrzegać podanych wartości stężeń. By doświadczenie miało szansę powodzenia należy koniecznie używać czystych naczyń.
Najpierw musimy sporządzić odpowiednie roztwory. Roztwór A przygotowujemy poprzez rozpuszczenie w 100cm3 wody takiej ilości chlorku sodu, by uzyskać roztwór nasycony w temperaturze pokojowej, a następnie dodanie do niego 5cm3 0,07M roztworu azotanu(V) srebra AgNO3. Podczas przygotowywania roztworu dochodzi do wytrącenia białego osadu chlorku srebra (fot. 2).
O ile chlorek srebra AgCl jest w czystej wodzie praktycznie nierozpuszczalny, to w stężonych roztworach chlorku sodu rozpuszcza się stosunkowo dobrze, co prowadzi do powstania kompleksów chlorkowych: AgCl2-, AgCl32- i AgCl43-. Można się o tym przekonać wytrząsając opisany roztwór - po chwili osad zniknie, a ciecz stanie się klarowna (fot. 3).
Roztwór B przygotowujemy dodając 0,5cm3 0,05M roztworu pięciowodnego siarczanu(VI) miedzi(II) CuSO4·5H2O do 100cm3 kwasu chlorowodorowego HCl o stężeniu 24%. Roztwór przyjmuje barwę zielonkawą (fot. 4), co jest spowodowane powstaniem kompleksów chlorkowych miedzi(II).
Roztwory po przygotowaniu muszą zostać pozostawione pod przykryciem do odstania na kilka godzin, tak by ewentualne zanieczyszczenia stałe miały szansę opaść na dno.
Doświadczenie
W celu przeprowadzenia doświadczenia należy pobrać do osobnych, niewielkich zlewek równe objętości roztworów A i B (np. 10-15cm3). Ważne jest by roztwory były czyste - obecność choćby niewielkich kryształków nierozpuszczonych substancji lub pyłków może uniemożliwić obserwację oczekiwanego efektu! Następnie należy zaciemnić pomieszczenie i po przyzwyczajeniu oczu do ciemności wlać niezbyt szybkim strumieniem roztwór A do roztworu B po ściance przechylonej zlewki. Sposób wlewania i mieszania substancji ma duże znaczenie, zanim osiągnie się zadowalające efekty może być konieczny trening. Eksperyment jest nieco kapryśny - jeśli za pierwszym razem się nie uda nie należy się zrażać, a tylko spróbować ponownie.
Jeśli wszystko przygotujemy poprawnie, to po kilku sekundach dostrzeżemy jasnoniebieskie błyski, szczególnie w pobliżu dna naczynia. Błyski światła trwają bardzo krótko, ale są stosunkowo łatwe do zauważenia. Całe zjawisko trwa zwykle kilkadziesiąt sekund.
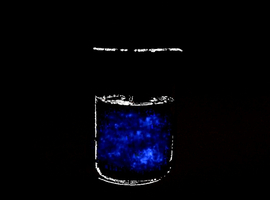
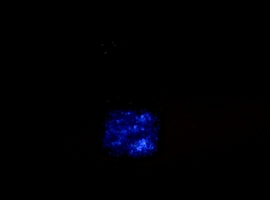
Krystaloluminescencja jest możliwa do zarejestrowania na fotografii (fot. 5) o wydłużonym czasie ekspozycji (ISO400, 60s).
Można zauważyć, że krystaloluminescencja jest rzeczywiście widoczna jako pojedyncze, rozłożone przypadkowo w objętości cieczy błyski światła. W dalszej części artykułu zostanie wyjaśnione, że każde zdarzenie emisji światła jest tutaj powiązane z powstaniem niewielkiego kryształu chlorku sodu, co można zauważyć obserwując mieszaninę na świetle. Są wtedy widoczne mikroskopijne kryształki chlorku sodu, powoli opadające na dno zlewki (fot. 6).
Wyjaśnienie
Po zmieszaniu kwasu chlorowodorowego HCl i nasyconego roztworu chlorku sodu NaCl dochodzi do zmniejszenia rozpuszczalności tego ostatniego. Jest to spowodowane wzrostem stężenia jonów chlorkowych Cl-. Chlorek sodu wytrąca się wtedy z roztworu w postaci kryształów.
W przypadku, kiedy w roztworze nie występują zarodki krystalizacji, jak na przykład nierozpuszczona sól, pęcherzyki powietrza czy pyłki kurzu, proces krystalizacji prowadzi do nagłego powstania wielu niewielkich kryształów.
Energia naprężeń powstałych w sieci krystalicznej tworzących się kryształów zostaje oddana do środowiska częściowo w postaci promieniowania elektromagnetycznego - światła niebieskiego i ultrafioletowego. Sprzyjają temu defekty sieci krystalicznej powstających kryształów. Powstanie takich defektów prowokujemy tutaj przez wprowadzenie do sieci niewielkiej ilości domieszek, takich jak jony miedzi Cu2+ czy srebra Ag+. W przypadku czystego chlorku sodu NaCl nie zaobserwowalibyśmy efektu, lub byłby on dużo słabszy i trudniejszy do zauważenia.
Bibliografia:
- 1. Cytat z Eschera za: Hodorowicz S. A., Krótka refleksja o krysztale i krystalografii, Alma Mater nr 136, 2011, s. 28,
- 2. Alexander A. J., Deep ultraviolet and visible crystalloluminescence of sodium chloride, Journall of chemical physics 2012, vol. 136.
Życzę miłej i pouczającej zabawy:)
Uzupełnienie autora
W artykule opublikowanym w czasopiśmie Fotografia 5 dla poprawienia czytelności została wydrukowana z zaznaczonym konturem naczynia. Poniżej przedstawiam oryginalną wersję zdjęcia, nie zawierającą tego dodatku:
Marek Ples