Niebiesko-pomarańczowa reakcja odwracalna
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (1/2020):

Kolorowa chemia
Heraklit z Efezu, grecki myśliciel żyjący na przełomie V i VI wieku przed naszą erą, stwierdził, że cechą właściwą wszystkiemu co nas otacza jest zmiana. Wyraził to w swojej słynnej maksymie πάντα ῥεῖ (panta rhei, z gr. "wszystko płynie"). Heraklit głosił, że najważniejszą cechą bytu jest ciągłe stawanie się się i przemijanie. Wszystko co istnieje się zmienia - nie ginie bezpowrotnie, ani też nie powstaje z niczego [1]. Fascynujące jest, że w ten poetycki sposób filozof przeczuł to do czego nauka doszła w wiele wieków później, a mianowicie zasadę zachowania energii, a także jej równoważność z materią.
Znakomicie w myśl Heraklita wpisuje się chemia - jest to przecież nauka zajmująca się opisem właściwości substancji, a także ich przemian zachodzących pod wpływem zróżnicowanych czynników. W murach szkoły, na etapie zaznajamiania z tajnikami tej dziedziny do młodych umysłów najbardziej przemawiają aspekty, które można zwizualizować za pomocą prostych, ale efektownych doświadczeń. Dlatego prezentowany dzisiaj eksperyment pozwala uzmysłowić sobie w naoczny sposób, jak zaskakujące mogą być przemiany chemiczne. W tym wypadku przejawiają się one odwracalnymi i kontrastowymi zmianami koloru cieczy.

Doświadczenie
W celu przeprowadzenia doświadczenia potrzebujemy zgromadzić substancje z poniższej, na szczęście niezbyt długiej listy:
- tetrahydrat winianu potasu sodu KNaC4H4O6·4H2O,
- pentahydrat siarczanu(VI) miedzi(II) CuSO4·5H2O,
- nadtlenek wodoru 3% H2O2.
Winian potasu sodu jest organicznym związkiem chemicznym, solą podwójną dikarboksylowego kwasu winowego C4H6O6 oraz dwóch metali alkalicznych: potasu K i sodu Na (Rys.1).
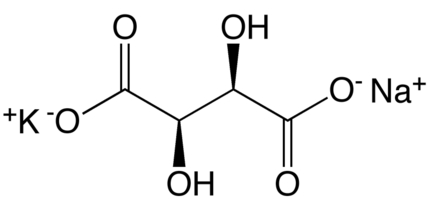
W handlu najczęściej występuje w postaci czterowodnej jako ciało krystaliczne o barwie białej (Fot.1).
Związek ten ma szerokie zastosowanie w przemyśle i nauce. Jest wykorzystywany między innymi jako czynnik kompleksujący kationy miedziowe Cu2+ w reakcjach na wykrywanie właściwości redukujących aldoz za pomocą odczynnika Fehlinga lub innych [2].
Winian potasu sodu jest stosowany od dawna w lecznictwie jako środek przeczyszczający, gdzie jest nazywany inaczej solą Seignette'a lub solą z Rochelle. Jako dodatek E337 znalazł zastosowanie w przemyśle spożywczym – pełni rolę przeciwutleniacza i regulatora kwasowości.
Nadtlenek wodoru H2O2 o stężeniu 3% to woda utleniona, do nabycia w każdej aptece. Pamiętajmy jednak, że w większych stężeniach substancja ta jest silnie żrąca i z łatwością niszczy nasze tkanki powodując zmiany martwicze i trudno gojące się oparzenia.
Jako źródło potrzebnych w układzie reakcyjnym dwudodatnich jonów miedzi Cu2+ użyjemy siarczan(VI) miedzi(II) w postaci pentahydratu CuSO4·5H2O. Jest to ciało krystaliczne o pięknej niebieskiej barwie (Fot.2).
Do ciekawostek należy zaliczyć fakt, że substancja ta była znana alchemikom jako witriol miedzi (łac. Vitriol coeruleum). Pamiętajmy, że związek ten jest solą metalu ciężkiego i jako taki ma toksyczne działanie na nasz organizm – wykazuje też dosyć silne właściwości grzybobójcze.
By móc przeprowadzić doświadczenie musimy przygotować następujące roztwory:
- A - 8,5g KNaC4H4O6·4H2O w 30cm3 wody,
- B - 20cm3 H2O2 3%,
- C - 1,25g CuSO4·5H2O w 5cm3 wody (do doświadczenia bierzemy 0,5cm3 tego roztworu) [3].
We wszystkich przypadkach musimy wykorzystać wodę destylowaną. Roztwory są trwałe, można je dosyć długo przechowywać w ciemności i najlepiej w obniżonej temperaturze, np. w lodówce.
Sposób wykonania
Roztwór A i B trzeba zmieszać razem – powstała w ten sposób ciecz jest w dalszym ciągu całkowicie bezbarwna i przejrzysta (Fot.3).
Mieszaninę następnie umieszczamy w kolbie o pojemności przynajmniej 100cm3 i ostrożnie ogrzewamy mierząc jej temperaturę. Przydatna jest wtedy płyta grzejna wyposażona w mieszadło magnetyczne, ale to ostatnie nie jest bezwzględnie konieczne (Fot.4).
Kiedy temperatura roztworu osiągnie 50°C, należy dodać roztwór C w objętości 0,5cm3. Ciecz przyjmuje wtedy głęboki, niebieski kolor – dużo bardziej intensywny niż barwa dodawanego roztworu (Fot.5). Pozostaje jednak w dalszym ciągu przejrzysta.
Kontynuując obserwacje możemy zauważyć, że po chwili roztwór zaczyna się silnie pienić, a jego temperatura wzrasta samorzutnie do prawie 90°C. W pewnym momencie ciecz przyjmuje piękną pomarańczowo-złotą barwę (Fot.6). Staje się wtedy także nieprzejrzysta. Zmiana jest bardzo gwałtowna – zachodzi dosłownie w mgnieniu oka.
Przejście barwne jest bardzo kontrastowe i widowiskowe. Często można usłyszeć wtedy mniej lub bardziej wyraźny okrzyk zdziwienia widzów.
Dodatek nowej porcji roztworu B powoduje powrót do postaci klarownej o niebieskiej barwie. Wystarczy jednak poczekać chwilę, by ciecz stała się na powrót pomarańczowa. Przejścia barwne można w ten sposób powtarzać wielokrotnie, pod warunkiem zachowania odpowiednio wysokiej temperatury cieczy.
Chciałbym jeszcze raz podkreślić, że ważne jest, aby prowadzić reakcję w naczyniu o odpowiednio dużej objętości. Powodem jest wydzielanie się w czasie procesu dużych ilości gazu i pienienie się cieczy - może dochodzić wtedy do rozprysku, a nawet wylania się części mieszaniny reakcyjnej z naczynia, jak to widać na Fot.7.
Poniżej przedstawiam także film ukazujący swoisty dramatyzm wspomnianego efektu:
Wyjaśnienie
Przedstawiona reakcja jest ciekawym przykładem procesu redoks. W jej trakcie skompleksowane przez reszty winianowe C4H4O62- jony miedzi Cu2+ zostają zredukowane z drugiego stopnia utlenienia na pierwszy. W opisanych warunkach powstaje wtedy zawiesina nierozpuszczalnego tlenku miedzi(I) zwanego inaczej kuprytem Cu2O - tego samego, który obserwujemy w razie uzyskania pozytywnego wyniku wspomnianej wcześniej reakcji Fehlinga [4]. Tlenek ten w postaci litej ma barwę ciemnoczerwoną lub nawet brązową, ale jako drobnokrystaliczna zawiesina w wodzie jest jasnopomarańczowy [5]. Z układu reakcyjnego wydostaje się mieszanina gazów, w większości składająca się z tlenu O2 uzyskanego na drodze rozkładu nadtlenku. Ważnym szczegółem jest jednak fakt, że wraz z tlenem powstają tutaj niewielkie ilość dwutlenku węgla CO2, najwyraźniej w wyniku utleniania winianu. Z obserwacji wynika, że w każdym cyklu zmiany barwy jedynie około 2-3% winianu ulega utlenieniu, dzięki czemu proces może być powtarzany kilkukrotnie dzięki dodatkowi nowych porcji nadtlenku wodoru i zachowaniu odpowiedniej temperatury. Można także zauważyć stopniowy wzrost pH środowiska reakcji od wartości bliskiej 5 na początku, do około 9 po kilku cyklach. Moment zmiany barwy (redukcja miedzi) jest związany z wyczerpaniem się w środowisku reakcji utleniacza, czyli nadtlenku wodoru. Kolejny dodatek tej substancji powoduje ponowne przeniesienie miedzi na drugi stopień utlenienia, a więc wyklarowanie roztworu i jego zmianę barwy na niebieską, co zapoczątkowuje kolejny cykl zmian koloru [6].
Literatura:
- [1] Leszczyński D., Filozofowie i ich filozofie. Opowieści dla niewtajemniczonych, Atlas, Wrocław, 2002, str. 19 - 21 powrót
- [2] Ples M., Kto pomieszał cukry? Mała analiza, Biologia w Szkole, 1 (2018), Forum Media Polska Sp. z o.o., str. 58 - 63 powrót
- [3] Roesky H.W., Möckel K., Niezwykły świat chemii, Wydawnictwo Adamantan, Warszawa, 2001, str. 63 - 64 powrót
- [4] Ples M., Reakcja Fehlinga, w serwisie: https://weirdscience.eu, dostępne online: https://weirdscience.eu/Pr%C3%B3ba%20Fehlinga.html [dostęp: 12.01.2020] powrót
- [5] Bielański A., Chemia ogólna i nieorganiczna, PWN, Warszawa, 1981, str. 632 powrót
- [6] Sherman M. C., Weil D., A reversible blue-and-gold reaction, Journal of Chemical Education, 1991, 68(12), str. 1037 powrót
Wszystkie fotografie i rysunki zostały wykonane przez autora
Marek Ples






