Parietyna - doskonalsza metoda pozyskiwania
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Biologia w Szkole (5/2018):

Z informacji jakie dotarły do mnie od Czytelników wynika, że opublikowany w poprzednim numerze Biologii w Szkole artykuł traktujący o dwóch naturalnie występujących substancjach o właściwościach fluorescencyjnych (berberynie i parietynie) spotkał się z pewnym zainteresowaniem [1]. Między innymi dlatego chciałbym dodatkowo przedstawić Czytelnikom inną od opisanej wcześniej - lepszą pod wieloma względami - metodę izolacji parietyny z materiału biologicznego. Jest ona w dalszym ciągu na tyle nieskomplikowana, by możliwe było jej zastosowanie w amatorskim, szkolnym lub uczelnianym laboratorium.
Obiekt zainteresowania
Tym Czytelnikom, którzy nie mieli okazji zapoznać się ze wspomnianym wcześniej artykułem wyjawię, że parietyna C16H12O5 jest pochodną antrachinonu, a jej strukturę opisuje Rys.1. Poza funkcjami biologicznymi może ona pełnić rolę wskaźnika kwasowo-zasadowego o właściwościach fluorescencyjnych.
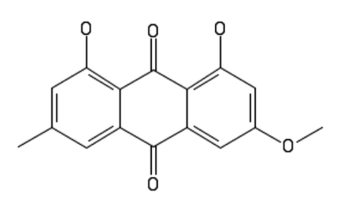
Związek ten wytwarzany jest m.in. przez wiele porostów Lichenes. Jednym z nich jest pospolity w Polsce złotorost ścienny Xanthoria parietina bytujący na korze drzew, skałach, czy nawet elementach betonowych. Jego plecha posiada barwę od żółtej do pomarańczowej (Fot.1).
Przypomnę też, że do doświadczeń wystarczy niewielki fragment plechy o powierzchni np. 1cm2. Nie należy więc niszczyć całych porostów, ponieważ wzrost tych organizmów jest dosyć powolny.
Najprostszą metodą pozyskania parietyny jest ekstrakcja z plechy porostu poprzez ucieranie z alkoholem etylowym C2H5OH, a następnie odsączenie. Przesącz zawiera wtedy wystarczające do doświadczeń ilości interesującej nas substancji, ale może być przy tym zanieczyszczony wieloma innymi związkami chemicznymi.
Izolacja na ciepło
Dla pozyskania parietyny w stanie dużo czystszym niż przez ekstrakcję alkoholem możemy zastosować jej interesującą właściwość. Okazuje się, że jest ona stosunkowo stabilnym termicznie związkiem i można wykorzystać tutaj zjawisko sublimacji [2].
Pierwszą czynnością, jaką musimy wykonać jest utarcie wysuszonej plechy złotorostu na proszek (Fot.2).
Konieczne jest przygotowanie małego zestawu do sublimacji/resublimacji, którego schemat przedstawia Rys.2. Jak widać, jego konstrukcja jest dosyć prosta. Składa się on z probówki a wypełnionej jak najzimniejszą wodą umieszczonej luźno w cylindrze b, tak by ścianki naczyń nie wchodziły w bezpośredni kontakt. Na dnie cylindra znajduje się sproszkowany materiał biologiczny c, który jest ostrożnie ogrzewany przez źródło ciepła d (palnik spirytusowy).
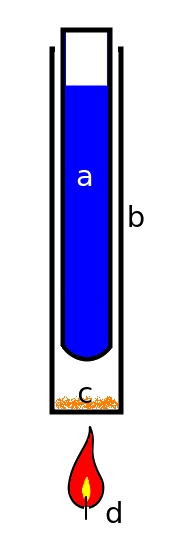
Zasada działania takiego zestawu jest prosta: parietyna sublimująca pod wpływem ogrzewania z materiału biologicznego krystalizuje w kontakcie z zimną powierzchnią probówki. Pozostałe substancje albo ulegają rozkładowi w tej temperaturze, albo nie sublimują i pozostają na dnie cylindra. W ten prosty sposób uzyskujemy oczyszczoną parietynę.
Gotowy do izolacji parietyny zestaw można zobaczyć na Fot.3.
Ogrzewanie należy prowadzić delikatnie, tak by można było obserwować delikatne wydzielanie się pomarańczowych par parietyny (Fot.4).
Ogrzewania nie należy prowadzić zbyt długo – należy je przerwać kiedy zauważymy, że probówkę pokrywa wyraźna warstwa żółtopomarańczowego nalotu, który można wyraźnie zauważyć po rozmontowaniu zestawu i wylaniu z naczynia wody chłodzącej (Fot.5).
Powstały nalot trzeba następnie rozpuścić w alkoholu etylowym, np. poprzez zanurzenie w nim probówki. Czystość uzyskanego w ten sposób barwnika jest dużo większa niż w przypadku prostej ekstrakcji.
Barwa alkoholowego roztworu parietyny jest żółta (Fot.6).
Roztwór parietyny jest trwały – należy go jednak przechowywać w szczelnie zamkniętym naczyniu i chronić przed światłem.
Czas próby
Należy oczywiście wypróbować pozyskaną substancję. Przy obserwacji w świetle widzialnym roztwór w środowisku kwaśnym lub obojętnym jest jaskrawożółty (Fot.7A), natomiast w wyniku dodatku zasady staje się czerwony (Fot.7B). Obserwacje w ciemności natomiast ujawniają wyraźną żółtopomarańczową fluorescencję w pierwszym przypadku (Fot.7C), zaś w drugim jej zanik (Fot.7D).
Jak widać, w przypadku roztworu parietyny pozyskanej i jednocześnie oczyszczonej na drodze sublimacji/resublimacji nie obserwujemy szczątkowej, czerwonej fluorescencji chlorofilu pochodzącego z symbiotycznych glonów porostu.
Literatura:
- [1] Ples M., Światło zimne z natury - berberyna i parietyna, Biologia w Szkole, 4 (2018), Forum Media Polska Sp. z o.o., str. 59-63 powrót
- [2] Weiß D., Fluoreszenzfarbstoffe in der Natur, w serwisie: http://www.chemie.uni-jena.de/institute/oc/weiss, dostępne online: http://www.chemie.uni-jena.de/institute/oc/weiss/naturstoffe.htm, [dostęp 28.01.2017] powrót
Autorem fotografii i rysunków jest Marek Ples.
Marek Ples






