Zegar cysteinowy
Reakcja z błyskiem
Opisywany w tym artykule proces jest przykładem tak zwanej reakcji zegarowej. Reakcja taka polega zwykle na sprzężeniu dwóch równoległych reakcji: szybkiej i powolnej. Efekt objawia się przeważnie zmianą barwy roztworu zachodzącą nagle po pewnym czasie - tak jest na przykład w przypadku łatwego do przeprowadzenia w warunkach domowych zegara jodowego. W prezentowanej reakcji jest jednak inaczej: zamiast zmiany barwy występuje tutaj błysk niebieskiego światła!
Potrzebne materiały
By móc przeprowadzić doświadczenie potrzebujemy:
- cysteinę C3H7NO2S,
- wodorotlenek sodu NaOH,
- siarczan(VI) miedzi(II) pięciowodny CuSO4·5H20,
- luminol (hydrazyd 3-aminoftalowy) C8H7N3O2.
Ostrzeżenie: W tym doświadczeniu wykorzystywany jest NaOH, który jest mocną zasadą i ma silne działanie żrące. Luminol ma działanie alergogenne i jest podejrzewany o właściwości rakotwórcze! Należy bezwzględnie unikać zanieczyszczenia oczu lub skóry! Autor nie bierze jakiejkolwiek odpowiedzialności za wszelkie mogące powstać szkody. Robisz to na własne ryzyko!
3-aminohydrazyd kwasu ftalowego, bardziej znany jako luminol, jest niestety stosunkowo drogim odczynnikiem. Na szczęscie jednak są potrzebne bardzo małe jego ilości, więc nawet pół grama tej substancji wystarczy do przeprowadzenia wielu ciekawych reakcji. Jego wzór strukturalny:
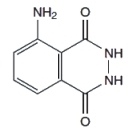
Można go też samemu zsyntezować, lecz wymaga to nieco zachodu. Dla chcącego nie ma nic trudnego! Dla tych, którzy chcieliby samodzielnie uzyskać tę substancję, zamieszczam opis przeprowadzonej przeze mnie syntezy luminolu. Poniżej zdjęcie próbki otrzymanego w ten sposób związku, który został wykorzystany także w tym doświadczeniu.
Cysteina jest organicznym związkiem chemicznym z grupy aminokwasów, czyli związków zawierających zarówno zasadową grupę aminową -NH2, jak i kwasową grupę karboksylową -COOH.
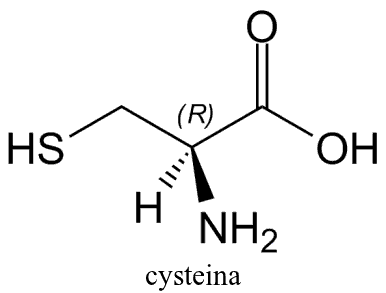
Cysteina, podobnie jak pozostałe aminokwasy, występuje w formie dwóch enancjomerów, będących swoimi lustrzanymi odbiciami. Poniżej, w postaci zwitterjonów, zostały przedstawione oba enancjomery cysteiny:

Do doświadczenia można użyć dowolnego z enancjomerów cysteiny, ich mieszaniny w dowolnym stosunku lub racematu.
Sposób przeprowadzenia
Pierwszą rzeczą, jaką musimy zrobić, jest przygotowanie trzech roztworów według poniższego opisu:
- A - 0,032g cysteiny w 100cm3 wody destylowanej,
- B - 1g wodorotlenku sodu i 0,02g luminolu w 100cm3 wody destylowanej,
- C - 0,1g pięciowodnego siarczanu(VI) miedzi(II) w 100cm3 wody destylowanej.
Roztwory mogą być przechowywane przez długi czas, o ile będą szczelnie zamknięte. Roztwory A i B najlepiej przechowywać w lodówce.
Przystępując do doświadczenia należy jednorazowo zmieszać w kolbie Erlenmeyera po 25cm3 roztworów A i B, oraz 1cm3 roztworu C. Mieszanina musi być następnie bardzo energicznie mieszana, na przykład za pomocą mieszadła magnetycznego. W razie jego braku, ciecz można po prostu silnie wytrząsać. By móc zaobserwować efekt, należy robić to w ciemności, tak jak to pokazuje poniższy film.
Jak widzimy, po pewnym czasie ciecz rozbłyskuje krótkotrwałym, ale wyraźnie widocznym niebieskim światłem.
Wyjaśnienie
Luminol jest związkiem, podczas utleniania którego dochodzi do chemiluminescencji, czyli emisji światła na drodze reakcji chemicznej. Zgodnie z opisanym tutaj mechanizmem tego procesu, by doszło do chemiluminescencji należy spełnić pewne warunki. Roztwór powinien być zasadowy - taki odczyn zapewnia użycie mocnej zasady sodowej NaOH. Potrzebny jest także katalizator, którym zwykle jest związek kompleksowy żelaza, na przykład heksacyjanożelazian(III) lub hem. Jak przekonaliśmy się jednak w toku doświadczeń, chemiluminescencja luminolu może być także katalizowana związkami miedzi, co wykorzystano w niniejszym doświadczeniu. Zauważmy jednak, że tym razem nie wykorzystujemy, jak zwykle w podobnych reakcjach, żadnego energicznego utleniacza! Skądinąd wiemy także, że woda jest silnym inhibitorem reakcji utleniania luminolu, więc w środowisku wodnym nie dochodzi do jego utleniania tlenem pochodzącym z powietrza. W takim razie należy zastanowić się, w jaki sposób tutaj może dochodzić do utleniania luminolu, które objawia się świeceniem?
Kluczowa jest tutaj rola cysteiny. Aminokwas ten, szczególnie w środowisku zasadowym, bardzo łatwo utlenia się tworząc dimery połączone mostkami dwusiarczkowymi (mostki takie pełnią podstawową funkcję w kształtowaniu przestrzennej konfiguracji białek). Dimery takie nazywa się cystyną. Reakcja dimeryzacji podczas energicznego mieszania zasadowego roztworu cysteiny zachodzi kosztem tlenu atmosferycznego: cysteina zostaje utleniona do cystyny, zaś tlen zredukowany do postaci nadtlenku wodoru H2O2 według równania reakcji:

Powstały nadtlenek wodoru jest na tyle energicznym utleniaczem, że może być wykorzystany do chemiluminescencyjnego utleniania luminolu.
W ten sposób wyjaśniliśmy kwestię powstania utleniacza koniecznego do zajścia reakcji. Dlaczego jednak reakcja zachodzi dopiero po określonym czasie? Odpowiedź jest prosta: wykazujące działanie katalityczne jony miedziowe są początkowo silnie skompleksowane przez pozostającą w roztworze cysteinę. Dopiero po przekształceniu całej dostępnej cysteiny w nieposiadającą zdolności kompleksowania miedzi cystynę, i co za tym idzie, wytworzeniu odpowiedniej ilości nadtlenku wodoru, dochodzi do utleniania luminolu, co obserwujemy w postaci emisji niebieskiego światła.
Czas zajścia reakcji można regulować poprzez ilość użytej cysteiny, oraz dobór intensywności mieszania, w ten sposób, że im mniej zastosuje się cysteiny i im energiczniej będzie mieszany roztwór, tym czas oczekiwania będzie krótszy.
Życzę miłej i pouczającej zabawy:)
Literatura dodatkowa:
- Hell R., Molecular physiology of plant sulfur metabolism, Planta, 202 (2), 1997, str. 138–148,
- Martens J., Offermanns H., Scherberich P., Facile Synthesis of Racemic Cysteine, Angewandte Chemie International Edition in English, 20 (8), 1981, str. 668,
- Pluciński T., Doświadczenia chemiczne, Wydawnictwo Adamantan, 1997, str. 25.
Marek Ples
