Fosfor - alchemiczne światło
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (2/2019):

Alchemia to dawna praktyka łącząca aspekty poruszane przez wiele dzisiejszych dziedzin naukowych, głównie chemię, fizykę, ale też sztukę, psychologię i inne. Najszerzej znanym celem adeptów alchemii było odkrycie metody transmutacji ołowiu - a także innych nieszlachetnych metali - w złoto, uzyskanie panaceum czyli leku przeciwko wszystkim chorobom oraz eliksiru nieśmiertelności. Pomóc miało w tym uzyskanie tzw. kamienia filozoficznego - tajemniczej substancji, na której bezskutecznym poszukiwaniu wielu spędziło całe życie.
Dziedzina ta jest dziś często wyszydzana z powodu naiwności (z dzisiejszego punktu widzenia) wielu działań i stwierdzeń poczynionych przez parających się nią ludzi. Alchemicy raczej nie stosowali nic, co moglibyśmy dzisiaj nazwać metodą naukową. Przyznać trzeba jednak, że prace niektórych z nich były bardzo systematyczne i przyniosły wymierne skutki. W każdym razie na gruncie przygotowanym przez alchemię mogła powstać później nauka w prawdziwym tego słowa znaczeniu, m.in. chemia. Zauważmy, że podobny proces przeszła astronomia, wyodrębniając się z mistycznej astrologii.
Ważnym osiągnięciem alchemików było odkrycie wielu nowych substancji. Jedną z nich był pierwiastek fosfor P, otrzymany po raz pierwszy przez Niemca Henniga (lub Henninga) Branda w 1669 roku [1]. Angielski malarz Joseph Wright tworzący w XVIII wieku przedstawił to zdarzenie na swoim obrazie (Fot.1).
Artysta zobrazował tutaj swoją wizję sceny z pracowni Branda. Zauważmy, że retorta zawierająca otrzymany fosfor świeci tajemniczym blaskiem. Nie jest to wymysł Wrighta, ale gwoli prawdy warto zaznaczyć, że poświata została przedstawiona ze sporą przesadą.
Dziś wiemy, że w tym przypadku świecenie jest efektem powolnego utleniania nowo odkrytego pierwiastka. Właśnie dlatego został on nazwany fosforem (gr. "phosphoros", czyli "niosący światło"). Interesujące, że gdyby zmieniono wtedy źródłosłów na łaciński, to substancja ta mogłaby zostać nazwana lucyferem, co miałoby to samo znaczenie (łac. "lux" - "światło" i "ferre" - "nieść", "przynosić"). Pozostawmy jednak na boku rozważania etymologiczne.
Czy adept sztuki chemicznej (pozostawiając alchemię historykom) chciałby zapoznać się z przynajmniej niektórymi interesującymi właściwościami fosforu? Myślę, że odpowiedź może być tylko twierdząca - szczególnie, że nie wymaga to zaawansowanego zaplecza laboratoryjnego. Chcę jednak z całą stanowczością zaznaczyć, że wszelkie doświadczenia z tą substancją należy wykonywać ostrożnie, pamiętając zawsze o pewnych jej niebezpiecznych cechach.
Wielość postaci
W przypadku fosforu mamy do czynienia ze zjawiskiem tzw. alotropii. Polega ono na tym, że w jednym stanie skupienia dany pierwiastek może występować w różnych odmianach, różniących się właściwościami fizycznymi i chemicznymi. Alotropy mogą różnić się między sobą strukturą krystaliczną lub liczbą atomów w cząsteczce [2].
Przemiany między odmianami alotropowymi są przemianami fazowymi pierwszego rodzaju, tj. takimi, w których zachodzi nieciągła zmiana funkcji stanu (np. entropii) przy zachowaniu równowagi termodynamicznej. Proces ten prowadzi do minimalizacji energii swobodnej układu. Pierwiastek może występować w dwóch różnych odmianach alotropowych w tej samej temperaturze, z tym że w danych warunkach jedna z form jest bardziej trwała.
Wiele pierwiastków wykazuje alotropię. Jednym z nich jest węgiel istniejący w postaci m.in. grafitu, diamentu, nanorurek itd.
Fosfor występuje w czterech odmianach alotropowych:
- fosfor biały (czasem nazywany także żółtym),
- czerwony (bezpostaciowy),
- fioletowy,
- czarny.
Dla nas najbardziej interesująca jest postać biała i czerwona. Pozostałe są mało reaktywne chemicznie, a przy tym ich otrzymywanie jest albo kłopotliwe (fosfor fioletowy - ogrzewanie fosforu czerwonego w próżni w temperaturze ponad 500°C lub krystalizacja z roztworu fosforu białego w ciekłym ołowiu) lub wręcz trudne do wyobrażenia (fosfor czarny - ogrzewanie fosforu białego bez dostępu tlenu w temp. 220 °C i pod ciśnieniem 12 tysięcy atmosfer) w warunkach wielu pracowni chemicznych – nie tylko szkolnych [3].
Czerwony i biały
Fosfor biały to najaktywniejsza chemicznie odmiana alotropowa fosforu. Ma on postać białawej lub żółtawej woskowatej substancji o temperaturze topnienia 44°C i gęstości 1,8 g/cm3 [4]. Cząsteczka tego alotropu składa się z czterech atomów ułożonych w czworościan foremny, czyli tetraedr.
Interesujące jest, że fosfor biały nie reaguje z wodą, chociaż trzeba go chronić przed kontaktem np. z powietrzem, ponieważ z racji swojej dużej aktywności wtedy się gwałtownie utlenia. Dlatego też tę odmianę alotropową przechowuje się pod powierzchnią wody destylowanej, w zamkniętych pojemnikach.
Fosfor biały jest bardzo silnie toksyczny. Dawka śmiertelna (wchłonięta drogą pokarmową lub wziewną) dla dorosłego człowieka wynosi ok. 0,1 g. Jest to jeden z powodów, dla których wszelkie operacje z tą substancją muszą być prowadzone bardzo ostrożnie, najlepiej na dnie odpowiedniej kuwety wykonanej z odpornego na wysoką temperaturę materiału (ceramicznej lub podobnej). Przy wszelkich pracach z białą formą fosforu – a także czerwoną – trzeba stosować bardzo rygorystyczne środki bezpieczeństwa. Konieczne są środki ochrony osobistej, a także przeciwpożarowej.
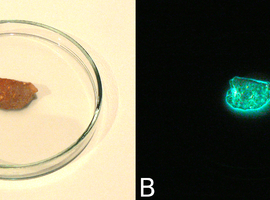
Chemiluminescencję fosforu białego można zaobserwować bardzo prosto, pobierając kilkumilimetrowy fragment tej substancji, osuszając go bibułą i umieszczając na niepalnej, nieraktywnej powierzchni. Odpowiednia w tym celu jest ceramika lub szkło żaroodporne. Powierzchnia wykorzystanego przeze mnie fragmentu jest pokryta wyraźnym nalotem produktów utleniania mimo przechowywania pod wodą, czego powodem jest wiek próbki (Fot.2A). Nie przeszkadza to jednak w przeprowadzeniu obserwacji.
Po zaciemnieniu pomieszczenia można zobaczyć wyraźny blask bijący od próbki (Fot.2B). Często udaje się nawet zaobserwować jej subtelną białozielonkawą barwę.
Opisane obserwacje musimy przeprowadzić jak najszybciej, ponieważ utleniający się fosfor stopniowo rozgrzewa się ulegając w końcu samozapłonowi. Nawet w postaci litej próbka może się zapalić w temperaturze kilkudziesięciu stopni (według niektórych źródeł już nawet powyżej 20°C) zaś w rozdrobnionej natychmiast. Płonący fosfor biały wytwarza bardzo wysoką temperaturę rzędu tysiąca stopni Celsjusza, często nie udaje się ugasić wodą, a także powoduje powstanie dużej ilości żrącego dymu składającego się głównie z tlenku P4O10 i produktów jego reakcji z wilgocią atmosferyczną. Tak więc natychmiast po zaobserwowaniu blasku fosfor należy przenieść od razu do pojemnika, pod powierzchnię wody.
Historyczna metoda wykrywania obecności fosforu (m.in. w tkankach otrutych nim ludzi) polega na obserwacji chemiluminescencji par fosforu białego wyizolowanego z badanego materiału. Jest to tak zwana próba Mitscherlicha.
Smutną kartą w dziejach chemii jest wykorzystanie fosforu białego w technice wojskowej – wystarczy tu wspomnieć o fosforowych bombach zapalających.
Drugą interesującą nas odmianą fosforu jest alotrop czerwony. Ma on postać ciemnoczerwonego proszku (Fot.3) i jest nierozpuszczalny w żadnych powszechnie wykorzystywanych w tym celu substancjach.
W odróżnieniu od fosforu białego nie jest toksyczny. Próbki należy jednak traktować nieufnie, ponieważ często są zanieczyszczone co prawda niewielką, ale z racji wysokiej toksyczności niebezpieczną ilością odmiany białej. Reaktywność fosforu czerwonego jest dużo mniejsza niż białego - nie utlenia się on w warunkach normalnych i nie musi być przechowywany pod wodą. Jego samozapłon wymaga dużo wyższej temperatury.
Chociaż operowanie fosforem czerwonym jest dużo bezpieczniejsze niż białym, to wykazuje on pewne cechy, które wymagają zachowania odpowiednich środków bezpieczeństwa. Możemy to sprawdzić w kontrolowanych warunkach zapalając na płytce ceramicznej odrobinę – dosłownie ułamek grama - tego alotropu (Fot. 4A). Spala się on mniej gwałtownie niż fosfor biały, produkując podobne ilości tlenku widocznego jako biały dym. Jeśli odciąć dostęp tlenu przykrywając substancję np. szklanym naczyniem to spalanie ustanie, jak można było się tego spodziewać (Fot.4B). Zdziwia może jednak, że po odkryciu fosfor samoczynnie rozpala się znowu. Dzieje się tak dlatego, że pod wpływem ciepła spalania część formy czerwonej przechodzi w białą, która w opisanych warunkach z łatwością ulega samozapłonowi, a płomień przenosi się na fosfor czerwony. Dlatego pożary z udziałem fosforu czerwonego bywają równie trudne do ugaszenia jak w przypadku odmiany białej.
Biały fosfor z zapałek
Zdaję sobie sprawę, że biała postać alotropowa fosforu nie jest łatwo dostępna. Z drugiej strony istnieje wiele powodów, dla których taki stan rzeczy jest korzystny, m.in. wspomniana wcześniej bardzo duża toksyczność tej substancji.
Cóż ma więc począć eksperymentator chcący samodzielnie przekonać się choćby w przybliżeniu co czuł Brand badając w swej alchemicznej pracowni właściwości odkrytej substancji? Na szczęście istnieje prosty sposób. Wykorzystamy w tym celu zwykłe zapałki (Fot.5).
Niektórzy z Czytelników pewnie się zdziwią, ponieważ wiadome jest, że od przełomu XIX i XX wieku ze względów bezpieczeństwa nie produkuje się zapałek o główkach zawierających fosfor biały. Opinia publiczna zaalarmowana wieloma przypadkami zatruć i pożarów - zapałki tego rodzaju często ulegały samozapłonowi - doprowadziła nawet do utworzenia międzynarodowej konwencji o zakazie używania białego fosforu w produkcji zapałek (Berno, 26 września 1906 roku). Polska przystąpiła do niej w 1921 roku [5].
W produkcji współczesnych zapałek nie wykorzystuje się więc białej odmiany alotropowej fosforu, ale w dalszym ciągu używana jest odmiana czerwona. Nie znajdziemy jej jednak w główkach zapałek, a w drasce, a raczej pokrywającej ją masie potarkowej. W jej skład poza wspomnianą substancją wchodzą także inne, np. zmielone szkło, mające nadawać jej odpowiednią szorstkość.
Aby przekształcić występujący w drasce fosfor czerwony w biały i zaobserwować jego chemiluminescencję należy odciąć ją od reszty pudełka, a następnie delikatnie oddzielić jak najcieńszą warstwę papieru z masą potarkową (Fot.6). Chodzi o to, by pozbyć się niepotrzebnie dużej ilości papieru, ponieważ pudełko jest wykonane z dosyć grubej tektury.
Papier trzeba następnie wygiąć wzdłuż w rodzaj rynienki, masą do środka i ułożyć na zimnej metalowej lub szklanej powierzchni, np. na dnie odwróconej szalki Petriego (Fot.7A). Papier należy podpalić (Fot.7B) co powinno spowodować jego zwęglenie (Fot.7C).
Po zwęgleniu należy usunąć pozostałości papieru. Można wtedy zauważyć smolisty nalot, który osadził się na chłodnej powierzchni szkła (Fot.8).
Właśnie ten nalot zawiera – obok produktów spalania papieru i impregnujących go substancji, farby itp. – niewielkie ilości fosforu białego, powstałego podczas ogrzania fosforu czerwonego wchodzącego w skład masy potarkowej. Jest go tam oczywiście niewiele, ale wystarczająco by po zaciemnieniu pomieszczenia i przyzwyczajeniu oczu do ciemności zauważyć delikatną, zielonkawą poświatę (Fot.9). Powierzchniowa warstwa nalotu dosyć szybko ulega utlenieniu i emisja światła traci na intensywności. Roztarcie nalotu eksponuje na wpływ powietrza nową partię chemiluminoforu i można wtedy zauważyć ponownie jaśniejsze świecenie. Oczywiście po pewnym czasie cały fosfor utleni się i proces ustanie.
Przedstawiona metoda jest stosunkowo bezpieczna, ponieważ w jej wyniku powstają jedynie śladowe ilości niebezpiecznej odmiany alotropowej fosforu. Oczywiście nie można w dalszym ciągu zapominać tutaj o ostrożności.
Nieco większe ilości fosforu białego można uzyskać umieszczając na dnie wąskiej probówki kilka miligramów fosforu czerwonego i – dla ochrony przed utlenianiem produktu – wypełniając naczynie dwutlenkiem węgla. Probówka powinna być zatkana zwitkiem waty szklanej. Jeśli ogrzać delikatnie płomieniem palnika dno probówki to alotrop czerwony zacznie przekształcać się w biały, który w tej temperaturze będzie parować. Gdy ścianki probówki będą jednocześnie chłodzone (np. warstwą mokrego papieru filtracyjnego) to pary fosforu białego zestalą się w kontakcie z nimi [6]. Po ochłodzeniu naczynia i wyjęciu zatyczki warstwa białawej substancji w kontakcie z powietrzem rozbłyśnie wyraźnie widocznym światłem (Fot.10). Odmienna barwa światła uchwyconego na fotografii jest wynikiem różnic w ustawieniach balansu bieli cyfrowego aparatu fotograficznego, którym zostało wykonane zdjęcie i w rzeczywistości była ona podobna jak w poprzednich przypadkach.
Chciałbym jeszcze raz przypomnieć: biały fosfor jest bardzo niebezpieczną substancją! Każdy, nawet maleńki odłamek wyrzucony np. do pojemnika na odpady po pewnym czasie może ulec samozapłonowi i spowodować pożar. Odrębnym zagrożeniem jest toksyczność tej substancji. Wszelkie pozostałości po eksperymentach należy unieszkodliwić np. poprzez spalenie w kontrolowanych warunkach lub dłuższe wytrząsanie z roztworem siarczanu(VI) miedzi(II) CuSO4, co przekształca fosfor do odpowiedniego fosforku [7].
Wyjaśnienie
Emisja światła przez fosfor biały jest spowodowana przez jego utlenianie, o czym nas przekonuje fakt, że ustaje ona w warunkach beztlenowych. Większość reakcji chemiluminescencyjnych można opisać ogólnym schematem:
W wyniku reakcji substratu X powstaje produkt przejściowy [Y]* istniejący początkowo w stanie wzbudzonym o wysokiej energii. Stan taki jest jednak bardzo nietrwały. Produkt przejściowy przekształca się więc spontanicznie w produkt ostateczny Y, o niższej energii. Nadwyżka energii zostaje oddana do środowiska w postaci energii promienistej hν.
W opisanych warunkach fosfor jest utleniany najpierw do mało lotnych, niższych tlenków, które są następnie utleniane do tlenku fosforu(V) P2O5 - czy raczej P4O10 co lepiej odwzorowuje strukturę tego związku. Właśnie ta reakcja jest odpowiedzialna za widoczne świecenie [8]. Udowadnia to fakt, że zbyt duża dostępność utleniacza (np. wprowadzenie fosforu do czystego tlenu) wyraźnie hamuje lub nawet prowadzi do zaniku chemiluminescencji, ponieważ powstaje wtedy bezpośrednio ostateczny tlenek.
Do opisywanego zjawiska wydaje się być podobna opisywana przeze mnie już kiedyś na łamach “Chemii w Szkole” chemiluminescencja zachodząca podczas utleniania sodu Na [9]. Jest to tym ciekawsze, że przecież obie substancje należą do zupełnie różnych grup: fosfor biały jest typowym niemetalem (jedynie alotrop czarny wykazuje właściwości półprzewodnikowe), natomiast sód typowym metalem.
Przekonaliśmy się, że fosfor wykazuje bardzo interesujące właściwości, a także o tym, iż chemiluminescencja nie jest tak rzadkim czy egzotycznym zjawiskiem jak może się wydawać. Możemy ją zaobserwować przy wykorzystaniu materiałów, które łatwo znaleźć w każdym domu.
Literatura:
- [1] Weeks M. E., The discovery of the elements (Supplementary note on the discovery of phosphorus), Journal of Chemical Education, 10 (5), 1933, str. 302 powrót
- [2] Gajewski W. (red.), Encyklopedia techniki - Chemia, Wydawnictwa Naukowo-Techniczne, Warszawa, 1965 powrót
- [3] Bielański A., Podstawy chemii nieorganicznej, PWN, Warszawa, 2002, str. 644 powrót
- [4] Averbuch-Pouchot M.T., Durif A., Topics in Phosphate Chemistry, World Scientific, 1996 powrót
- [5] Oświadczenie Rządowe o przystąpieniu Polski do konwencji międzynarodowej o zakazie używania białego (żółtego) fosforu przy wyrobie zapałek, podpisanej w Bernie dnia 26 września 1906 roku, dostępne online: http://prawo.sejm.gov.pl/isap.nsf/DocDetails.xsp?id=WDU19220190159 [dostęp: 4.03.2019] powrót
- [6] Ples. M., Chemiluminescencja fosforu, w serwisie: http://www.weirdscience.eu/, dostępne online: http://weirdscience.eu/Chemiluminescencja%20fosforu.html [dostęp: 4.03.2019] powrót
- [7] Roesky H.W., Mockel K., Doświadczenia chemiczne, Wydawnictwo Adamantan, Warszawa, 2001, str. 43 powrót
- [8] Pluciński T., Doświadczenia chemiczne, Wydawnictwo Adamantan, Warszawa, 1997, str. 14-15 powrót
- [9] Ples M., Chemiluminescencja metalicznego sodu, Chemia w Szkole, 1 (2014), Wydawnictwo EduPress, str. 5-7 powrót
Wszystkie fotografie i rysunki (poza Fot.1) zostały wykonane przez autora
Uzupełnienie autora
Przebieg i efekt doświadczenia można zobaczyć też na poniższym filmie:
Mimo swojej prostoty efekt jest warty polecenia.
Marek Ples