Barwne kontrasty - reakcja oscylacyjna Briggsa-Rauschera
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (3/2022):

Zmiany, zmiany!
Zmiany towarzyszą nam na każdym kroku. Mottem dzisiejszego artykułu będzie poniższy wyjątek z książki australijskiej autorki, pani Canavan.
Nic nie pozostaje takie samo. Jedyne, czego można być, w życiu pewnym, to zmiana.
Szczególną klasą często szalenie efektownych, a przy tym także wręcz fascynujących reakcji chemicznych są te, w czasie których dochodzi do samoorganizacji. Terminem tym nazywa się spontaniczne powstawanie w układzie uporządkowanych struktur lub korelacji czasowych. Procesy prowadzące do tego mogą być natury chemicznej, fizycznej lub mieszanej [1].
Jednym z najwcześniej zbadanych przykładów samoorganizacji jest powstawanie charakterystycznych pierścieni opisanych dokładnie po raz pierwszy w 1896 roku przez Raphaela Eduarda Lieseganga [2]. Zjawiska związane z samoorganizacją występują powszechnie w naturze i - w ostatnich dekadach widzimy to coraz wyraźniej - pełnią najprawdopodobniej doniosłą rolę w wielu procesach biologicznych. Skala zdarzeń, na które wpływ mają fenomeny samoorganizacji jest bardzo szeroka, bo zaczyna się już od mikroświata, kiedy pod uwagę bierzemy spójnie zachowujące się zespoły drobin chemicznych lub nawet pojedyncze cząsteczki, do wręcz kosmicznej, ponieważ to właśnie temu fenomenowi zawdzięczamy najwyraźniej np. pasmową budowę pierścieni okalających planetę Saturn.
Jednym z przejawów samoorganizacji jest istnienie tzw. reakcji oscylacyjnych, które były tak odmienne od znanych wcześniej i uważanych właściwie za jedyne reakcji o monotonicznym charakterze przemian, że początkowo środowisko naukowe wręcz odmawiało uznania ich istnienia. Potwierdzeniem tego może byś przykra historia radzieckiego chemika Borysa Pawłowicza Biełousowa. Chcąc opisać zaobserwowane przez siebie oscylacje w układzie zawierającym kwasy organiczne i katalizowanym przez związku ceru Ce napotkał na niedowierzanie środowiska naukowego i problemy z publikacją wyników swoich prac, co miało tak katastrofalny wpływ na stan nerwowy naukowca, że musiał zasięgać porady lekarskiej [3].
Znane nam współcześnie reakcje oscylacyjne możemy klasyfikować na różne sposoby, często dzieli się je na zachodzące w układach jednorodnych i niejednorodnych. Same oscylacje mogą być czasowe, przestrzenne i przestrzenno-czasowe. Wprowadzanie do dydaktyki eksperymentów związanych z tego rodzaju egzotycznymi reakcjami może wydawać się nieco ryzykowne. Warto wziąć jednak pod uwagę, że mimo często bardzo skomplikowanego w szczegółach mechanizmu, pozwalają one na zaciekawienie tematyką kinetyki chemicznej. Jest to wielką pomocą dydaktyczną, zwłaszcza, że wspomniany dział chemii bywa często uznawany przez uczniów i studentów – a bywa też, że i nauczycieli - za jednocześnie mało ciekawy i trudny.

Reakcją oscylacyjną, która szczególnie dobrze nadaje się do celów dydaktycznych i pokazowych, jest reakcja Briggsa-Rauschera (B-R). W jej trakcje dochodzi do bardzo kontrastowych przemian barwnych [4].
Doświadczenie
Aby przeprowadzić doświadczenie potrzebujemy:
- kwas siarkowy(VI) H2SO4 stężony,
- jodan potasu KIO3,
- kwas malonowy C3H4O4,
- siarczan manganu(II) w postaci monohydratu MnSO4·H2O,
- nadtlenek wodoru H2O2 30%,
- skrobia.
Jodan potasu w warunkach normalnych jest białym ciałem stałym, umiarkowanie rozpuszczalnym w wodzie. Nie posiada zapachu. W temperaturze topnienia rozkłada się z wydzieleniem jodu. Jest dosyć dobrym utleniaczem - reaguje z materiałami łatwopalnymi, czasem wręcz wybuchowo. Jodan potasu stosowany jest powszechnie do jodowania soli kuchennej, w której jednak jego koncentracja jest bardzo niska. Jest także stosowany w leczeniu przypadków wchłonięciu radioaktywnego jodu w celu jego wyparcia z tarczycy.
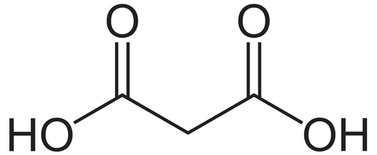
Kwas malonowy lub - stosując nazewnictwo systematyczne - kwas propanodiowy, to organiczny związek chemiczny z grupy kwasów dikarboksylowych (Rys.1). Jego sole i estry są nazywane malonianami, a nazwa pochodzi od łacińskiego słowa malum oznaczającego jabłko. Silnie drażni skórę i błony śluzowe. Jego moc jest zbliżona do mocy kwasu octowego. W warunkach normalnych jest białą substancją krystaliczną.
Monohydrat siarczanu(VI) manganu (II) w warunkach normalnych jest ciałem stałym, krystalicznym, o delikatnie różowej barwie. Dobrze rozpuszcza się w wodziei posiada właściwości higroskopijne. Temperatura topnienia tego związku wynosi 57–117°C, co jest spowodowane stopniową utratą wody krystalicznej. Sól bezwodna topi się natomiast dopiero w temperaturze 700°C.
Trzeba pamiętać, że kwas siarkowy(VI) oraz nadtlenek wodoru są silnie żrące i powodują ciężkie oparzenia. Jodan potasu i siarczan manganu(II) są toksyczne, a kwas malonowy ma działanie drażniące. Trzeba zachować ostrożność i stosować środki ochrony osobistej, jak zawsze zresztą przy pracy w laboratorium!
Ostatnią substancją jakiej potrzebujemy jest skrobia. Najwygodniej byłoby użyć tzw. skrobi rozpuszczalnej, ale w razie jej braku możemy wykorzystać zwykłą skrobię (mąkę) ziemniaczaną (Fot.1).
Roztwór skrobi ziemniaczanej przygotowujemy w prosty sposób, rozprowadzając w kilkunastu centymetrach sześciennych zimnej wody destylowanej szczyptę tej substancji, a następnie zalewając ją 200cm3 wody podgrzanej bezpośrednio przedtem do wrzenia. Po ostudzeniu roztwór należy przesączyć, zbierając klarowną lub nieco mętną ciecz (Fot.2).
O tym, że roztwór jest przygotowany prawidłowo możemy się przekonać dodając do niego kilka kropli jodyny (alkoholowego roztworu jodu, lub jodu w wodnym roztworze jodku potasu KI) – ciecz powinna wtedy przybrać charakterystycznie granatową, prawie czarną barwę (Fot.3).
Przystępując do właściwego doświadczenia musimy przygotować trzy roztwory:
- A – 4,3g jodanu potasu rozpuścić w 80cm3 wody, dodać 0,45cm3 stężonego kwasu siarkowego(VI) i uzupełnić wodą do 100cm3,
- B – 1,56g kwasu malonowego i 0,34g monohydratu siarczanu(VI) manganu(II) rozpuścić w 50cm3 wody i uzupełnić roztworem skrobi do 100cm3,
- C – 40cm3 nadtlenku wodoru 30% uzupełnić wodą do 100cm3.
Do przygotowania roztworów trzeba oczywiście wykorzystać wodę destylowaną lub demineralizowaną, ponieważ nie może ona zawierać jonów chlorkowych Cl- będących inhibitorami opisywanej reakcji. Proces jest skalowalny, to znaczy można dostosować objętość układu reakcyjnego do swoich potrzeb, odpowiednio zmniejszając lub zwiększając proporcjonalnie ilości reagentów. Dla podanych ilości powinniśmy zaobserwować przynajmniej kilka, kilkanaście cykli spontanicznych przemian barwnych – w razie potrzeby wydłużenia procesu warto przeskalować potrzebne ilości substancji [5].
W momencie rozpoczęcia pokazu wszystkie roztwory powinny mieć temperaturę pokojową lub nieco niższą. Początkowo wszystkie roztwory są bezbarwne, jedynie ten zawierający skrobię może być nieco mętny.
Podczas reakcji trzeba zapewnić dokładne wymieszanie roztworów – przydatne jest mieszadło magnetyczne. Roztwory muszą być dodawane w podanej kolejności!
Do naczynia umieszczonego na mieszadle zlewamy razem roztwory A i B – ich mieszanina także jest bezbarwna (Fot.4).
Po chwili, podczas której oba roztwory powinny się jak najdokładniej wymieszać, dodajemy do naczynia także roztwór C – pociąga to za sobą praktycznie natychmiastową zmianę barwy na wyraźnie żółtą (Fot.5).
Nie powinniśmy się jednak przyzwyczajać do tej konkretnej barwy, ponieważ już po chwili cała objętość roztworu w mgnieniu oka stanie się granatowa, prawie czarna (Fot.6A).
Po pewnym czasie roztwór odbarwia się (Fot.6C), następnie nabiera żółtego zabarwienia (Fot.6B), po czym znowu następuje barwa granatowa i cykl się zamyka.
Okres zmian barwnych może wynosić od kilkunastu do kilkudziesięciu sekund, w zależności od temperatury roztworów i staranności odważenia składników.
Oscylacje po pewnym czasie słabną i zatrzymują się – roztwór pozostaje w fazie o barwie granatowej i daje się wyczuć charakterystyczna, drażniąca woń pierwiastkowego jodu.
Wyjaśnienie
Podtytuł niniejszego rozdziału jest nieco przekorny, ponieważ o ile prezentowane reakcje chemiczne są nieskomplikowane w przygotowaniu, to wyjaśnienie ich dokładnego mechanizmu nie jest już takie proste, a na pewno wykracza w pewnych aspektach znacznie poza zakres wiedzy ucznia, czy nawet studenta. Wystarczy powiedzieć, że wiele modeli tego typu procesów zakłada, że w układzie zachodzi jednocześnie nawet kilkadziesiąt wzajemnie na siebie wpływających reakcji chemicznych. Z tego powodu poniżej przedstawię jedynie najważniejsze z nich.
W czasie reakcji jony jodanowe(V) ulegają redukcji do kwasu jodowego(I) HIO pod wpływem nadtlenku wodoru, przy czym następuje wydzielanie wolnego tlenu w myśl równania:
Wspomniany kwas reaguje dalej z nadtlenkiem wodoru, dzięki czemu powstają jony jodkowe:
Co ciekawe, jony jodkowe reagują następnie z kwasem jodowym(I) według:
W wyniku uzyskujemy pierwiastkowy jod. Opisane procesy powodują zabarwienie roztworu na zaobserwowany, żółty kolor. Wolny jod reaguje z kolei z jonami jodkowymi, przechodząc w trójjodek:
Właśnie trójjodki tworzą ze skrobią granatowy kompleks.
Zauważmy jednak, że równolegle trwa ciągle reakcja jodu z kwasem malonowym:
Kolejną reakcją zużywającą pierwiastkowy jod jest:
W wyniku obu reakcji zużywany jest pierwiastkowy jod, co prowadzi do zaniku granatowego kompleksu, a jednocześnie na powrót powstają jony jodanowe(I).
Przedstawione reakcje pozwalają na wytłumaczenie zmian barwnych podczas reakcji, ale nie mówią, dlaczego powstają oscylacje zamiast monotonicznych zmian stężeń reagentów. Dokładne wytłumaczenie wybiega poza ramy niniejszego opracowania, warto jednak wiedzieć, że duże znaczenie mają tu procesy katalityczne i autokataliczne.
Powyższy przepis na reakcję Briggsa-Rauschera został sprawdzony przeze mnie i wielokrotnie wypróbowany własnoręcznie. Istnieją też oczywiście i inne, które można wypróbować z jak najlepszym skutkiem, także takie, w których kwas siarkowy(VI) zastąpiono np. kwasem chlorowym(VII) HClO4 [6].
Literatura:
- [1] Bray W. C., A Periodic Reaction in Homogeneous Solution and Its Relation to Catalysis, Journal of the American Chemical Society, 1921, 43(6), str. 1262-1267 powrót
- [2] Ples M., Porządek z chaosu. O samoorganizacji i pierścieniach Lieseganga, Chemia w Szkole, 1 (2016), Agencja AS Józef Szewczyk, str. 15-19 powrót
- [3] Gudowska-Nowak E., Reakcje oscylacyjne, Foton, (90) 2005, str. 16-19 powrót
- [4] Briggs T.S., Rauscher W.C., An Oscillating Iodine Clock, Journal of chemical Education, 1973, 50, str. 496 powrót
- [5] Recreating the Briggs-Rauscher oscillating reaction, w serwisie: https://www.youtube.com, dostępne online: https://www.youtube.com/watch?v=SCoLMfplVWs [dostęp: 16.05.2022] powrót
- [6] Orlik M. Reakcje oscylacyjne – porządek i chaos, Wydawnictwa Naukowo-Techniczne, Warszawa, 1996, str. 338 powrót
Wszystkie fotografie i rysunki zostały wykonane przez autora
Marek Ples





