Zimnolubny kameleon
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie Antocyjan (3/2017):

Chemia jest jedną z nauk przyrodniczych, czyli takich, które zajmują się badaniem świata materialnego, najczęściej z zastosowaniem aparatu matematycznego, przy wykorzystaniu właściwej sobie metodologii.
Podobnie jak naukowcy innych dziedzin chemicy powinni zawsze zachowywać równowagę między teorią, a empirią. Należy to zwykle rozumieć w ten sposób, że doświadczenie i opisujący je model matematyczny muszą się wzajemnie uzupełniać prowadząc do efektu, jakim jest poszerzenie zasobu naszej wiedzy.
W edukacyjnej praktyce szkolnej, a w mniejszej mierze także w uczelnianej, niestety kładzie się coraz większy nacisk na aspekty teoretyczne zaniedbując przy tym często praktykę. Powody mogą być różnorodne: od niedofinansowania pracowni przedmiotowych, poprzez brak chęci dużej części środowiska nauczycielskiego i uczniowskiego, problematyczne rozwiązania w zakresie programów nauczania, aż do spraw związanych z regulacjami w dziedzinie bezpieczeństwa i higieny pracy.
Chciałbym jednak zaznaczyć, że sprawa nie jest beznadziejna. Możliwe jest w dalszym ciągu opracowanie oraz zaprezentowanie ciekawych, a przy tym prostych doświadczeń. Mogą one zainteresować uczniów i tym samym pomóc im w wejściu na drogę do zrozumienia czasem nawet skomplikowanych zjawisk, a także znalezienia w tym przyjemności.
Z przedstawionych wyżej powodów chciałbym opisać proste i efektowne doświadczenie, które pomaga w zrozumieniu praw rządzących przemianami energii na poziomie molekularnym. Myślę, że po przeczytaniu całości Szanowny Czytelnik nie będzie miał już wątpliwości dlaczego nazwałem je imieniem tego sympatycznego zwierzątka, które posiadło zdolność zmiany swego ubarwienia.
Doświadczenie
Do wykonania doświadczenia potrzebujemy niewielkiej ilości riwanolu w formie stałej. W aptekach bywa on dostępny w formie tabletek lub rzadziej proszku. Jedną z postaci handlowych tej substancji jest też niskoprocentowy roztwór wodny – odparowując go w niskiej temperaturze można uzyskać wystarczające do doświadczenia ilości riwanolu.
Chemiczny wzór strukturalny riwanolu przedstawia Rys.1. Z chemicznego punktu widzenia jest to mleczan etakrydyny o wzorze sumarycznym C18H21N3O4. Jest wykorzystywany jako środek odkażający.

Trzeba pamiętać, że w większych ilościach związek ten może działać toksycznie na organizm, a po zwilżeniu pozostawia na skórze trudne do usunięcia plamy. Należy zachować ostrożność.
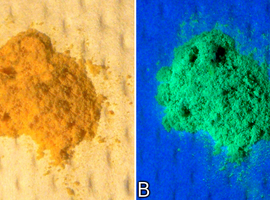
Riwanol jest w temperaturze pokojowej krystalicznym ciałem stałym o barwie żółtej (Fot.1A). Omawiana substancja dobrze rozpuszcza się w wodzie, a jej temperatura topnienia wynosi 226°C.
Ciekawą rzecz zaobserwujemy natomiast po oświetleniu kryształów riwanolu światłem ultrafioletowym. Zaczynają one wtedy fluoryzować bardzo jasno, a barwa emitowanego światła jest jasnozielona (Fot.1B).
Także wodne roztwory wykazują bardzo jasne świecenie pod wpływem UV nawet przy bardzo niskich stężeniach – riwanol jest bardzo wydajnym barwnikiem fluorescencyjnym (Fot.2). Dostrzegalną gołym okiem fluorescencję można zaobserwować nawet przy stężeniach rzędu 0,000001%, co odpowiada rozpuszczeniu 100mg (jednej tabletki) riwanolu w 10 tonach wody [1].
No dobrze - wiemy już, że roztwory riwanolu fluoryzują pod wpływem światła UV. Obiecywałem jednak eksperyment, który na razie z niezbyt jasnych powodów nazwałem zimnolubnym kameleonem.
By przygotować to doświadczenie musimy sporządzić roztwór riwanolu w glicerolu (glicerynie) C3H8O3. Glicerol jest trójhydroksylowym alkoholem i można go kupić w aptece. Ważne jest jednak, by substancja ta zawierała jak najmniejszy dodatek wody, ponieważ jej nadmiar utrudnia zaobserwowanie interesującego nas efektu.
Następnie do pewnej ilości glicerolu należy dodać dosłownie odrobinę barwnika. W takich warunkach riwanol rozpuszcza się stosunkowo powoli – proces można przyspieszyć dzięki mieszaniu. Powinniśmy w ten sposób uzyskać lekko zielonkawy roztwór (Fot.3). Ważne jest aby nie był on zbyt stężony.
Teraz musimy się zatroszczyć o chłodzenie i to dosyć wydajne. Dobrze sprawdzi się tutaj suchy lód czyli zestalony dwutlenek węgla CO2, który sublimując zachowuje temperaturę około -78°C. Oczywiście jest tu konieczna ostrożność, ponieważ tak niska temperatura może z łatwością spowodować głębokie i trudno gojące się odmrożenia.
Suchy lód najlepiej przechowywać w odpowiednich pojemnikach termoizolacyjnych wykonanych np. ze styropianu.
Zaciemniając pomieszczenie i oświetlając w temperaturze pokojowej próbkę glicerolowego roztworu riwanolu światłem UV można zauważyć jaskrawozieloną i bardzo jasną fluorescencję (Fot.4A). Jeśli jednak schłodzimy ciecz do temperatury suchego lodu (np. zamykając ją na jakiś czas w pojemniku z tą substancją) to barwa fluorescencji roztworu wyraźnie się zmieni – stanie się niebieskozielona (Fot.4B).
Różnica barw jest wyraźna i można ją zademonstrować nawet przed dosyć dużym audytorium. Dobrze jest przy tym umożliwić porównanie próbki schłodzonej z zachowaną w temperaturze pokojowej.
Po schłodzeniu i silnym naświetleniu ultrafioletem można też dostrzec krótkotrwałą fosforescencję roztworu. Jest ona znacznie lepiej widoczna po schłodzeniu próbki do temperatury wrzącego w warunkach normalnych azotu, tj. do -196°C.
Wyjaśnienie
Wiemy, że zjawisko fluorescencji opiera się na wzbudzeniu cząstek barwnika [2]. W celu zobrazowania mechanizmów rządzących tym fenomenem szczególnie przydatne są tzw. diagramy Jabłońskiego [3]. Odpowiednie w omawianym przypadku uproszczone diagramy przedstawia Rys.2.
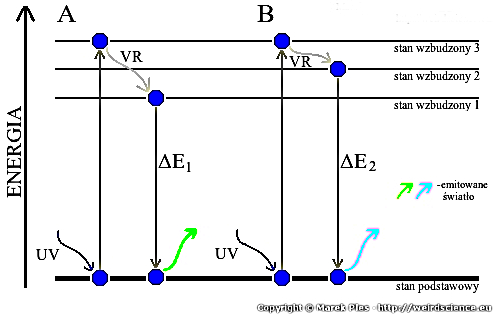
Naturalnie przez większość czasu cząstka znajduje się w stabilnym stanie podstawowym, tzn. o najniższej energii. Sytuacja może się jednak zmienić po pochłonięciu odpowiedniej porcji energii w postaci światła ultrafioletowego UV - następuje wtedy przejście do stanu wzbudzonego o wyższej energii, np. 3.
Część energii wzbudzenia zostaje jednak prawie natychmiast rozproszona na drodze przejścia wibracyjnego VR. Z tego powodu cząstka przechodzi na niższy stan wzbudzony (1 lub 2).
Pamiętajmy jednak, że stabilny jest stan o możliwie najniższej energii. Dlatego bardzo szybko zachodzi kolejny przeskok, tym razem do stanu podstawowego. Różnica energii ΔE zgodnie z zasadą zachowania zostaje oddana do środowiska w postaci promieniowania elektromagnetycznego o odpowiedniej długości fali. Promieniowanie emitowane z powodu strat ma niższą energię niż promieniowanie wzbudzające - zjawisko to nazywamy przesunięciem Stokesa.
Rozważmy jednak wpływ temperatury na opisywane zjawiska. Wiemy, że cząstki w temperaturach wyższych od zera absolutnego intensywnie drgają. Amplituda owych drgań rośnie wraz z temperaturą. Dlatego w sytuacji A (w wyższej temperaturze) podczas przejścia wibracyjnego VR zostanie rozproszona większa ilość energii niż w przypadku B. Co logiczne, w wyniku VR cząstka w sytuacji A przyjmie niższy stan energetyczny niż w B (1 w A, 2 w B). Podczas powrotu do stanu podstawowego różnica energii ΔE1 ma mniejszą wartość niż ΔE2. Długość fali emitowanego światła, a więc i jego barwa jest związana z energią fali elektromagnetycznej. Różnica energii ΔE1 odpowiada więc światłu zielonemu, zaś ΔE2 niebieskozielonemu.
Opisane zjawisko jest całkowicie odwracalne – po ogrzaniu do temperatury pokojowej powraca zielona barwa fluorescencji.
Literatura:
- [1] Ples M., Więcej światła! O fluorescencji riwanolu, Chemia w Szkole, 6 (2015), Agencja AS Józef Szewczyk, str. 16-18 powrót
- [2] Kawski A., Fotoluminescencja roztworów, Wydawnictwo Naukowe PWN, 1992 powrót
- [3] Jabłoński A., Efficiency of Anti-Stokes Fluorescence in Dyes, Nature, 131 (3319), 1933, str. 839-840 powrót
Wszystkie fotografie i rysunki wykonane przez autora.
Marek Ples