Więcej światła! O fluorescencji rywanolu
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (6/2015):
Tytuł niniejszego artykułu zapożyczyłem od Johanna Wolfganga von Goethego, znakomitego niemieckiego poety przełomu XVIII i XIX wieku [1]. Poza twórczością literacką z zamiłowaniem zajmował się on także naukami przyrodniczymi. Słowa te były niestety jego ostatnimi. Ja jednak chciałbym właśnie od nich zacząć.
Zjawiska związane z emisją światła należą do jednych z najbardziej fascynujących, przynajmniej ze względu na efekt wizualny. Luminescencja czyli inaczej jarzenie lub zimne świecenie należy do takich właśnie fenomenów. Polega ona na emisji fal elektromagnetycznych z zakresu światła widzialnego (także podczerwieni i ultrafioletu) wywołanej w inny sposób niż przez rozgrzanie ciał do wysokiej temperatury. Istnieje wiele rodzajów luminescencji, w zależności od czynnika ją wywołującego. Tym razem chciałbym wspomnieć o fluorescencji, w której czynnikiem wzbudzającym jest światło o odpowiedniej długości fali. Co ważne, zjawisko uznaje się za fluorescencję, gdy emisja zanika bardzo szybko (w ciągu 10-8s) po ustaniu promieniowania wzbudzającego [2].
Fluorescencję wykazuje wiele substancji. Niektóre z nich są pochodzenia naturalnego, z przykładami w postaci choćby chininy C20H24N2O2 i protoporfiryny IX C34H34N4O4. Inne natomiast zostały wytworzone sztucznie, np. fluoresceina C20H12O5 i eozyna Y C20H6Br4Na2O5. Nie wszystkie z nich nadają się do wykorzystania w działalności edukacyjnej lub popularyzacyjnej, np. z racji wysokiej ceny, niedostępności czy toksyczności. Dlatego w niniejszym artykule chciałbym zaproponować Szanownemu Czytelnikowi wykorzystanie bardzo wydajnego, a przy tym nietoksycznego, taniego i łatwego do zdobycia fluoroforu, jakim jest rywanol.
Doświadczenie
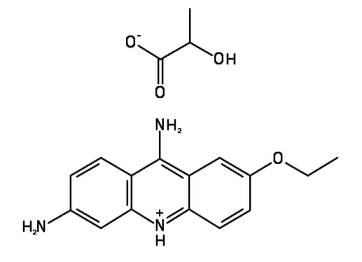
Rywanolem jest zwyczajowo nazywany mleczan 6,9-diamino-2-etoksyakrydyny o wzorze sumarycznym C18H21N3O4 (Rys.1). Związek ten należy do grupy barwników akrydynowych.
Z punktu widzenia eksperymentatora rywanol jest bardzo obiecującą substancją, ponieważ wykorzystuje się go w lecznictwie jako środek odkażający i z tego powodu jest łatwo dostępny w aptekach. W temperaturze pokojowej ma on postać drobnych pomarańczowo-żółtych kryształków (Fot.1A), a formą handlową są najczęściej tabletki lub gotowy roztwór o stężeniu 0,1% [4].
Wystarczy jednak oświetlić próbkę rywanolu światłem ultrafioletowym, by przekonać się, że związek ten nawet w stanie stałym posiada silne właściwości fluorescencyjne. Barwa emitowanego światła jest jasnozielona (Fot.1B).
Fluorescencję wykazują też wodne roztwory rywanolu. Zadajmy sobie pytanie, od czego właściwie powinna zależeć intensywność fluorescencji takiego roztworu przy stałej intensywności czynnika wzbudzającego? Może od stężenia?
Nie poprzestańmy jednak na rozważaniach teoretycznych, tym bardziej, że nie jest trudno przeprowadzić odpowiednie doświadczenie.
Należy przygotować roztwory o odpowiednich rozcieńczeniach. Jako wyjściowe przyjmijmy stężenie 0,1%, ponieważ takie właśnie posiada handlowy roztwór rywanolu używany do odkażania skóry. Następnie przygotujmy serie dziesięciokrotnych rozcieńczeń. Ile? To zależy od Czytelnika. Ja proponuję rozwinięcie serii rozcieńczeń przynajmniej do jednej milionowej części procenta. W charakterze próbki kontrolnej najlepiej zastosować wodę destylowaną.
Jako źródła światła ultrafioletowego najkorzystniej jest użyć lampy kwarcowej z filtrem Wooda, ale sprawdzają się też „czarne” świetlówki kompaktowe UV. Bardzo dobre wyniki można uzyskać także z niebieskim wskaźnikiem laserowym. Warto jednak zaznaczyć, że długość fali światła wysyłanego przez takie wskaźniki wynosi zwykle 405nm, jest więc to w rzeczywistości światło fioletowe, dosyć bliskie ultrafioletowi.
Wyniki doświadczenia przedstawia Fot.2. Co ciekawe, dla stężeniu 0,1% fluorescencję o barwie jasnozielonej, tj. takiej samej jak w przypadku stałego rywanolu można zaobserwować jedynie w przypowierzchniowej warstwie cieczy, zaś wiązka laserowa nie wnika w głąb roztworu (Fot.2A). Przy dziesięciokrotnym rozcieńczeniu można zauważyć rozszerzenie się warstwy świecącej cieczy; zaczyna być także widoczna fluorescencja na drodze wiązki laserowej (Fot.2B). Przy stężeniu równym 0,001% roztwór fluoryzuje już bardzo intensywnie w całej objętości (Fot.2C). Przy dalszym rozcieńczaniu intensywność emisji światła maleje, lecz jest wyraźnie zauważalna (Fot.2D-E). Dla stężenia 0,000001% fluorescencja jest zdecydowanie słabsza, ale w dalszym ciągu widoczna, szczególnie w przypadku oświetlenia laserem (Fot.2F). Dla stwierdzenia fluorescencji tak rozcieńczonego roztworu przy oświetleniu lampą może być konieczne porównanie z próbą kontrolną nie wykazującą efektu (Fot.2G).
Sytuacja z Fot.2F odpowiada rozpuszczeniu jednej stumiligramowej tabletki rywanolu w 10 tonach wody. Uzmysławia to jak wydajnym fluoroforem jest ta substancja.
Opisane właściwości rywanolu umożliwiają przeprowadzanie efektownych doświadczeń. Przy normalnym świetle rozcieńczony roztwór rywanolu jest bezbarwny, więc nie odróżnia się od czystej wody destylowanej. W takich warunkach nie można więc stwierdzić, która ze zlewek przedstawionych na Fot.3 zawiera omawianą substancję.
Proponuję zaaranżowanie sytuacji, w której wybrany uczeń na oczach całej grupy zmienia kolejność naczyń, ale tak by nauczyciel nie wiedział, w której znajduje się rywanol. Następnie prowadzący przy użyciu źródła światła UV może bardzo łatwo rozpoznać naczynie zawierające tę substancję (Fot.4A). Szczególnie korzystne wydaje się zastosowanie wspomnianego uprzednio wskaźnika laserowego, ponieważ nie wymaga to zaciemniania pomieszczenia (Fot.4B).
Właściwości luminescencyjne rywanolu mogą znaleźć zastosowanie nie tylko w nauczaniu chemii, ale także pokrewnych dziedzin. Obserwacje odbicia promienia laserowego w obrębie roztworu (Fot.5) przywodzą na myśl możliwość wykorzystania tej substancji także w nauczaniu fizyki, a konkretniej w bardzo efektownej wizualizacji praw optyki.
Odpowiednie doświadczenie nie jest wymagające technicznie – wystarczy oświetlić wskaźnikiem laserowym zwierciadła lub soczewki różnego typu zanurzone w roztworze rywanolu.
Uzyskane w ten sposób obrazy przedstawia Fot.6. Myślę, że trudno o bardziej dobitne wyjaśnienie biegu promieni odbitych od zwierciadła wklęsłego, zbiegających się w charakterystycznym dla każdego zwierciadła punkcie, czyli ognisku (Fot.6A). Odbicie od zwierciadła płaskiego przypomina natomiast o zasadzie głoszącej, że kąt padania jest równy kątowi odbicia (Fot.6B).
Wyjaśnienie
Cząstka barwnika fluorescencyjnego (rywanolu) w normalnych warunkach występuje w stanie podstawowym o niskiej energii. Można ją wzbudzić do stanu o wyższej energii np. za pomocą światła o określonej długości fali. Pamiętajmy także, że długość fali elektromagnetycznej jest związana z niesioną przez nią energią w ten sposób, że dłuższym falom odpowiadają niższe wartości energii.
Stan wzbudzony jest oczywiście nietrwały - cząstka powraca w bardzo krótkim czasie do stanu podstawowego. Uwolniona przy tym energia zostaje przekazana do środowiska w postaci fali elektromagnetycznej z zakresu światła widzialnego. Z racji strat energetycznych związanych m.in. z drganiami cieplnymi cząstek, wypromieniowane światło ma większą długość fali niż pochłonięte. Zjawisko to obserwujemy w opisanych doświadczeniach; światło wzbudzające pochodzi z niebieskiego krańca widma, zaś barwa fluorescencji jest zielona, czyli rzeczywiście przesunięta w kierunku fal o większej długości (ku czerwieni). Nazywamy to przesunięciem Stokesa [5].
Ciekawe jest też wyjaśnienie faktu słabej fluorescencji stosunkowo stężonych roztworów rywanolu (Fot.2A i Fot.2B). Okazuje się, że w przy takich wartościach stężeń dochodzi do powstania dimerów cząsteczek barwnika. Energia wzbudzenia może być w takiej sytuacji efektywnie przekształcana w energię cieplną. Dodatkowym czynnikiem może też być powtórne pochłanianie światła wyemitowanego na drodze fluorescencji. Cała energia światła wzbudzającego zostaje więc bardzo szybko rozproszona i dlatego fluorescencję obserwujemy jedynie w przypowierzchniowej warstwie cieczy [6].
Jak widzimy, nawet tak łatwo dostępna i tania substancja jaką jest rywanol może nam pomóc w zrozumieniu praw rządzących na tak podstawowym, molekularnym poziomie materii. Rywanol nie jest przy tym toksyczny, a już na pewno nie są niebezpieczne silnie rozcieńczone roztwory tego związku. Pozwala mi to stwierdzić, że wykorzystanie tej substancji w celach edukacyjnych jest jak najbardziej godne polecenia.
Literatura:
- [1] Ursel M., „Więcej światła”. O ostatnich słowach wielkich romantyków polskich, w: Kolbuszewski J. (red.), Problemy współczesnej tanatologii, t. VI, Wrocław, 2002, str. 301–307 powrót
- [2] Kittel C., Wstęp do fizyki ciała stałego, Polskie Wydawnictwo Naukowe, Warszawa, 1976 powrót
- [3] Ples M., Ab Ovo - fluorescencja roztworu porfiryn wyizolowanych ze skorupy jaja kurzego, Chemia w Szkole, 6 (2014), Agencja AS Józef Szewczyk, str. 19-21 powrót
- [4] Altmeyer P., Bacharach-Buhles M., Springer Enzyklopädie Dermatologie, Allergologie, Umweltmedizin, Springer, Berlin, 2002, str. 1775 powrót
- [5] Albani J.R., Structure and Dynamics of Macromolecules: Absorption and Fluorescence Studies, Elsevier, 2004, str. 58 powrót
- [6] Pluciński T., Doświadczenia Chemiczne, Wydawnictwo Adamantan, Warszawa, 1997, str. 30 powrót
Marek Ples





