Sztuczna komórka w praktyce
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Biologia w Szkole (1/2021):

Każdy człowiek, a w szczególności przyrodnik zadaje sobie czasem pytanie o to, czym właściwie jest życie. Intuicyjnie wydaje się nam, że potrafimy udzielić odpowiedzi na to pytanie, ale kiedy zastanowimy się głębiej nad tym tematem to zaczynamy sobie zdawać sprawę z jego problematyczności.
Biorąc pod uwagę zróżnicowane kryteria możemy stwierdzić, że najważniejszą cechą tego niesamowicie skomplikowanego procesu fizykochemicznego - określanego przez nas życiem - jest zdolność i jednocześnie potrzeba ciągłej wymiany materii i energii z otoczeniem. Oczywiście, znane nam organizmy żywe wykazują także inne właściwe sobie cechy. Jedną z nich jest zdolność do rozmnażania się, co wynika z ograniczonego czasu życia każdego osobnika.
Najprostszymi formami życia są pojedyncze komórki. Posiadane przez nas dzisiaj techniki pozwalają na syntezowanie w sposób sztuczny wielu organicznych substancji chemicznych - często o bardzo wysokim stopniu złożoności i właściwie poza sposobem powstania nie różniących się niczym od tych występujących w naturze. A jednak, nawet najprostsza komórka ciągle się wymyka jeszcze naszemu poznaniu jako całość - mimo, że wiemy już bardzo dużo, można sądzić, że wiele jeszcze czasu minie zanim będziemy zdolni do sztucznego wytwarzania struktur choćby w przybliżeniu tak skomplikowanych jak te najprostsze mikroorganizmy.
Żywy organizm podlega takim samym prawom fizycznym jak każdy nieożywiony przedmiot. Życie ma jednak to do siebie, że jako skomplikowany zespół różnorodnych procesów wymaga ciągłego dopływu energii w celu utrzymania ich uporządkowania, a więc zachowania niższej entropii w stosunku do otoczenia. Na tym opiera się fizykalna interpretacja zjawiska homeostazy. Wynika z tego także, że życie jako zespół sprzężonych procesów powinno dać się opisać za pomocą zależności fizycznych, chemicznych czy matematycznych; poznanie praw nim rządzących powinno pomóc nam je zrozumieć. Jak już jednak wspomniałem, największym problemem jest tutaj stopień komplikacji omawianych zjawisk.
Zgodnie z teorią komórkową Schwanna podstawową jednostką strukturalną i organizacyjną życia jest komórka. Nie istnieją twory żywe o mniejszym stopni komplikacji niż komórka. Zależy to jednak od definicji życia. W każdym razie przyjmuje się dzisiaj, że wirusy, wiroidy i priony pozbawione struktury komórkowej i własnego metabolizmu nie należą do kategorii organizmów żywych - mimo, ze wykazują pewne ich cechy.
Według uproszczonego modelu komórka przedstawia sobą rodzaj niewielkiego pęcherzyka pokrytego błoną komórkową (w przypadku komórek roślinnych także ścianą komórkową) i wypełnionego właściwymi sobie organellami komórkowymi zawieszonymi w bezpostaciowym cytozolu. Występowanie wewnątrz komórki jądra zawierającego materiał genetyczny jest podstawą podziału organizmów na jądrowe (eukarionty, łac. Eucaryota) i bezjądrowe (prokarionty, łac. Procaryota). U większości prokariontów, roślin, grzybów i niektórych innych grup organizmów na zewnątrz błony komórkowej występuje dodatkowo charakterystyczna struktura o złożonej i zróżnicowanej budowie – ściana komórkowa. Jest to struktura martwa, nie wykazująca własnego metabolizmu. Wewnątrz komórki znajduje się cytoplazma, a u eukariontów także szereg wewnętrznych organelli pełniących określone funkcje, np. mitochondria, plastydy, aparat Golgiego, wakuole i inne.
Zauważmy, że rola błon (czy to błony komórkowej, czy też błon otaczających organella) jest bardzo ważna. Jak już stwierdziliśmy, życie na poziomie molekularnym jest złożonym zespołem ściśle sprzężonych procesów fizyko-chemicznych i z tego powodu wymaga do ich prowadzenia odpowiednich warunków, m.in. oddzielenia środowiska wewnętrznego od zewnętrznego. Z drugiej strony, błona komórkowa jako bariera nie może być jcałkowicie nieprzepuszczalna, ponieważ żadna komórka nie mogłaby żyć jako układ pozbawiony możliwości wymiany materii i energii z otoczeniem.
Biorąc pod uwagę powyższe, możemy stwierdzić, że błona komórkowa z jednej strony musi stanowić barierę oddzielającą wnętrze komórki od środowiska zewnętrznego, a jednocześnie umożliwiać transport pewnych substancji. Takie warunki spełnia błona (membrana) półprzpuszczalna.
Zjawisko polegające na wybiórczym przepływie określonych substancji przez błonę półprzepuszczalną nazywamy osmozą. Wiele fenomenów z nią związanych możemy obserwować na przykładzie naturalnych błon biologicznych – jest z nim związana choćby łatwa do zbadania nawet w warunkach szkolnych plazmoliza [1] [2]. Co ciekawe, podobne zjawiska możemy obserwować także w przypadku układów sztucznych, a niektóre z nich swoim zachowaniem przypominają w niektórych aspektach żywe komórki. Tak jest na przykład z tzw. komórką Traubego i tzw. krzemianowymi ogrodami chemicznymi, które bez problemów możemy wyhodować w naszej pracowni. Na początek musimy jednak przypomnieć sobie nieco wiadomości na temat samej osmozy.
Zjawisko osmozy
Błona półprzepuszczalna to taka bariera, która przepuszcza niektóre rodzaje cząsteczek, a zatrzymuje inne. Mogą przez nią przenikać np. niewielkie cząsteczki rozpuszczalnika, swobody takiej nie mają duże cząsteczki substancji rozpuszczonej lub jony.
Osmozę napędza dyfuzja, będąca procesem samorzutnego – a więc nie wymagającego dopływu energii – rozprzestrzeniania się cząsteczek materialnych lub energii w dowolnym ośrodku (chociaż w ciele stałym zachodzi dużo wolniej niż w gazie lub cieczy) o temperaturze wyższej od zera absolutnego. Na poziomie molekularnym dyfuzja jest efektem chaotycznych zderzeń cząstek substancji dyfundującej między sobą i z cząstkami ośrodka.
Zastanówmy się jednak, co się stanie w przypadku, kiedy za pomocą błony półprzepuszczalnej rozdzielimy dwa roztwory o zróżnicowanym stężeniu (Rys.1). Zauważmy, że w prawej części naczynia stężenie substancji rozpuszczonej jest dużo większe niż w lewej. Przez zaznaczoną w postaci szarej przegrody błonę półprzepuszczalną mogą przenikać jedynie niebieskie cząstki rozpuszczalnika, natomiast dużo większe czerwone cząstki substancji rozpuszczonej nie mają takiej możliwości.
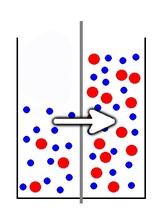
W takim przypadku cząsteczki rozpuszczalnika mają częstszy kontakt z błoną po stronie o niższym stężeniu substancji rozpuszczonej, która stanowi w pewien sposób konkurencję w dostępie do owej błony. Powoduje to, że więcej cząsteczek rozpuszczalnika przenika przez błonę w kierunku od roztworu mniej stężonego do bardziej stężonego, niż odwrotnie, co właśnie nazywamy osmozą. Zauważmy, że w jej wyniku dochodzi do powolnego wyrównywania się stężeń roztworów po obu stronach błony półprzepuszczalnej: roztwór o niższym stężeniu ulega zatężeniu poprzez odpływ rozpuszczalnika, zaś bardziej stężony ulega rozcieńczeniu przez jego dopływ. Widomym tego efektem jest podnoszenie się poziomu cieczy po prawej (na Rys.1) stronie przegrody.
Roztwór o niższym stężeniu nazywa się hipotonicznym, natomiast ten o wyższym stężeniu, hipertonicznym. Gdy roztwory pozostają w równowadze osmotycznej (tzn. wymiana rozpuszczalnika zachodzi w tym samym tempie w obu kierunkach), roztwory stają się względem siebie izotoniczne.
Sztuczna komórka
Komórka Traubego, nazywana też czasami nieco na wyrost sztuczną komórką została po raz pierwszy wytworzona w połowie XIX wieku przez niemieckiego chemika Moritza Traube. Aby powtórzyć doświadczenia przeprowadzone przez tego badacza potrzebujemy:
- pentahydrat siarczanu(VI) miedzi(II) CuSO4·5H2O,
- heksacyjanożelazian(II) potasu K4[Fe(CN)6]·3H2O.
Uwodniony siarczan(VI) miedzi(II) jest niebieski (Fot.1). W postaci krystalicznej sól ta bywa nazywana witriolem miedzi lub sinym kamieniem. W naturze występuje w sąsiedztwie pokładów rud miedzi jako chalkantyt – piękny minerał kolekcjonerski.
Drugą potrzebną nam substancją jest uwodniony heksacyjanożelazian(II) potasu. Nazywa się go często – szczególnie w dawniejszej literaturze – żelazocyjankiem potasu lub żółtą solą Gmelina [3]. Heksacyjanożelaziany(II) są solami kompleksowymi, w których atomem centralnym jest żelazo na II stopniu utlenienia, a ligandami 6 anionów cyjankowych (Rys.2). Struktura tej substancji chemicznej odznacza się swoistym geometrycznym pięknem.
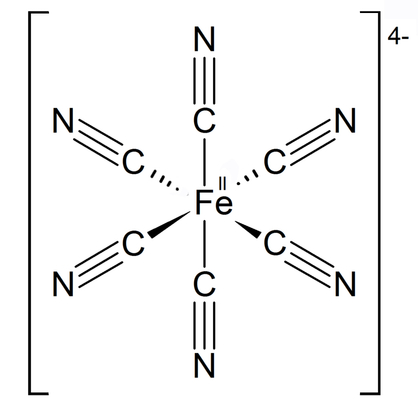
Heksacyjanożelazian(II) potasu w warunkach normalnych występuje jako żółtawe kryształy (Fot.2).
Co ciekawe, mimo że omawiany związek można uważać za pochodną silnie trującego cyjanowodoru HCN, to z powodu wysokiej trwałości kompleksu jest on praktycznie nietoksyczny. Koniecznie trzeba jednak pamiętać, że w reakcji heksacyjanożelazianów z mocnymi kwasami dochodzi do uwolnienia wspomnianego uprzednio skrajnie niebezpiecznego gazu! Pamiętajmy więc, aby nigdy nie dopuszczać do kontaktu soli Gmelina lub pozostałości po doświadczeniu z jakimikolwiek kwasami.
Chociaż w doświadczeniach nie używamy tym razem żadnych toksycznych czy niebezpiecznych z innych powodów substancji ani materiałów, to musimy jak zawsze zachować ostrożność i stosować odpowiednie środki ochrony osobistej.
Chciałbym w tym miejscu zaznaczyć, że potrzebny nam związek posiada swoje rodzeństwo - bardzo podobne, ale o nieco odmiennych właściwościach. Jest to heksacyjanożelazian(III) potasu K3[Fe(CN)6], który jednak odznacza się pięknym czerwonym kolorem, bardzo odmiennym od żółtej barwy potrzebnego nam hezacyjanożelazianu(II) potasu. Pamiętajmy jednak aby nie pomylić tych dwóch substancji.
Jeśli posiadamy już obie potrzebne substancje, to kolejną rzeczą jaką musimy zrobić jest przygotowanie roztworu soli miedzi. Odpowiednie będzie stężenie w zakresie 5-7%, a nawet nieco większe. Roztwór taki ma wyraźnie błękitne zabarwienie.
Aby wytworzyć komórki Traubego, do takiego roztworu musimy wrzucić kilka niezbyt małych kryształów heksacyjanożelazianu(II).
Postęp procesu początkowo jest najłatwiej śledzić za pomocą szkła powiększającego. Kryształki początkowo wydają się ciemnieć. Po chwili staje się widoczne, że to nie same kryształy zmieniają barwę, a raczej tworzy się wokół nich brunatna błonka. Co ciekawe, zaczyna ona dosyć szybko powiększać swoją objętość i wręcz w oczach rosnąć. Po chwili błona zaczyna tworzyć wypustki skierowane ku górze, w kierunku powierzchni roztworu. Po paru minutach możemy podziwiać w naczyniu twory przypominające np. wodorosty, polipy, gałązki i całe rośliny (Fot.3).
Powstałe struktury odznaczają się delikatnością, ale – póki nie wstrząsamy zbyt silnie naczyniem – są dosyć trwałe i można je dosyć długo przechowywać razem z cieczą.
Innym przykładem podobnego fenomenu jest tworzenie się tak zwanych ogrodów chemicznych. Aby je otrzymać wystarczy wrzucić do wodnego roztworu krzemianu sodu lub potasu (dostępnego w handlu jako tzw. szkło wodne) kilka kryształów rozpuszczalnych soli metali takich jak żelazo Fe, kobalt Co, Nikiel Ni, miedź Cu, srebro Ag i innych [4]. W ten sposób zapoczątkujemy wzrost struktur o różnych kształtach i barwach, które uformują w końcu piękny, podwodny ogród stanowiący dzieło tej pseudowegetacji (Fot.4).
Zauważmy, że opisane struktury, mimo całkowicie nieorganicznego pochodzenia, przejawiają pewne podobieństwa funkcjonalne do organizmów żywych – wykazują między innymi zdolność do wzrostu. Jak przekonamy się dalej, podobieństwa sięgają nawet głębiej.
Wyjaśnienie
Nieprzypadkowo wcześniej wspomniałem o osmozie, pełni ona bowiem doniosłą rolę w formowaniu komórek Traubego i chemicznych ogrodów.
Po wrzuceniu kryształu heksacyjanożelazianu(II) dochodzi na jego powierzchni do reakcji z jonami Cu2+ (pochodzącymi z dysocjacji soli miedzi), co prowadzi do powstania brunatnego heksacyjanożelazianu(II) miedzi(II) o wzorze Cu2[Fe(CN)6]. Związek ten jest w odróżnieniu od obu substratów praktycznie nierozpuszczalny w wodzie, dzięki czemu dochodzi do powstania szczelnej błony na powierzchni kryształu - co ważne, ma ona właściwości błony półprzepuszczalnej. Wewnątrz błony tworzącej pęcherzyk stężenie rozpuszczonej soli jest dużo większe niż na zewnątrz, więc na skutek osmozy wpływa do niego woda, a tym samym ciśnienie wewnątrz rośnie – pociąga to za sobą rozdęcie pęcherzyka, a w końcu jego pęknięcie [5]. Wtedy część stężonego roztworu ulega wylaniu na zewnątrz, dochodzi do kolejnej reakcji i powstania w miejscu pęknięcia nowej błony półprzepuszczalnej. Opisany proces powtarza się cyklicznie, dając w końcu twory podobne do rosnących roślin lub innych struktur biologicznych.
Analogicznie powstają ogrody krzemianowe – jedyna różnica jest taka, że błona półprzepuszczalna jest w tym przypadku utworzona przez krzemiany odpowiednich metali [6] [7].
Zauważmy, że nasze „sztuczne komórki” w sposób wybiórczy – chociaż na zasadzie transportu biernego – wymieniają ze swoim środowiskiem materię, co umożliwia im obserwowany przez nas wzrost i uzyskanie ostatecznej formy. W tym sensie owe struktury naśladują niektóre z najprostszych procesów życiowych zachodzących w prawdziwych komórkach [8].
Opisane doświadczenie w interesujący sposób ukazuje zjawisko osmozy, które często wydaje się jednym z trudniej uchwytnych w życiu codziennym fenomenów. Trzeba jednak pamiętać, że pełni ono niebagatelną rolę w tym najciekawszym zjawisku, które nazywamy życiem – wiele błon biologicznych jest przecież właśnie błonami półprzepuszczalnymi.
Literatura:
- [1] Ples M., Niezwykłe bariery. O błonach półprzepuszczalnych i osmozie, Biologia w Szkole, 3 (2017), Forum Media Polska Sp. z o.o., str. 52-58 powrót
- [2] Ples M., Biała czy czerwona? O wyższości niektórych odmian cebuli w kontekście obserwacji plazmolizy, Biologia w Szkole, 2 (2020), Forum Media Polska Sp. z o.o., str. 54-57 powrót
- [3] Lide D. R. (red.), CRC Handbook of Chemistry and Physics, CRC Press, 2002 powrót
- [4] Roesky H.W., Möckel K., Niezwykły świat chemii, Wydawnictwo Adamantan, 2001, str. 23-24 powrót
- [5] Cartwright J. H. E., Escribano B., Sainz-Díaz C. I., Stodieck L. S., Chemical Garden Formation, Morphology, and Composition. II. Chemical Gardens in Microgravity, Langmuir, 27(7), 2011, str. 3294-3300 powrót
- [6] Ples M., Chemiczne rośliny, Chemia w Szkole, 5 (2015), Agencja AS Józef Szewczyk, str. 6-9 powrót
- [7] Ples M., Chemiczny ogród, w serwisie: www.weirdscience.eu, dostępne online: http://weirdscience.eu/Chemiczny%20ogr%C3%B3d.html [dostęp: 10.04.2017] powrót
- [8] Alberts B., Bray D., Johnson A., Lewis J., Raff M., Roberts K., Walter P., Podstawy biologii komórki. Wprowadzenie do biologii molekularnej, Wydawnictwo Naukowe PWN, Warszawa, 1999 powrót
Autorem fotografii i rysunków jest Marek Ples.
Marek Ples



