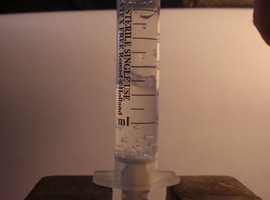
Woda wrząca w temperaturze pokojowej
Czym jest wrzenie?
Chcąc opisać słowami fizyki czym jest wrzenie musimy stwierdzić, że jest to zjawisko przemiany cieczy w gaz. Podczas wrzenia powstają pęcherzyki pary nasyconej. Parowanie zachodzi w każdej temperaturze, lecz jedynie w temperaturze wrzenia ciecz paruje w całej swojej objętości. Wrzenie wymaga dostarczania energii do wrzącego ciała, dlatego jest to przejściem fazowym pierwszego rodzaju.
Należy pamiętać, że wrzenie jest możliwe przy odpowiednim ciśnieniu w każdej temperaturze, w której może istnieć ciecz. Jest to możliwe między punktem potrójnym, a punktem krytycznym. Przy danym ciśnieniu zewnętrznym wrzenie cieczy zachodzi w określonej temperaturze, zwanej temperaturą wrzenia.
Wzrost ciśnienia zewnętrznego powoduje wzrost temperatury wrzenia, gdyż ciśnienie pary musi się zrównać z ciśnieniem zewnętrznym co wymaga podwyższenia temperatury. Wynika to w prosty sposób z równania Clapeyrona. Przy ciśnieniu jednej atmosfery fizycznej woda wrze w temperaturze 100°C.
Temperatura wrzenia silnie zależy od ciśnienia. Przy ciśnieniu niższym niż jedna atmosfera fizyczna woda wrze w temperaturze niższej niż 100°C. I właśnie ten fakt pozwoli nam na przeprowadzenie prostego, ale efektownego doświadczenia.
Praktyka!
Potrzebujemy jedynie nowej, szczelnej strzykawki lekarskiej. Możemy ją kupić po kilkadziesiąt groszy w każdej aptece. Do naszych celów najlepiej nadają się strzykawki o pojemności 5ml, ale mogą też być inne.
Wykonanie doświadczenia jest bardzo proste. Do strzykawki należy nabrać niewielką ilość wody o temperaturze pokojowej. Wystarczy 1 lub dwa mililitry. Przyciskając tłoczek należy pozbyć się ze strzykawki wszelkich widocznych pęcherzyków powietrza. Następnie należy zatkać palcem otwór wylewowy strzykawki i z całych sił pociągnąć za tłoczek. Jeśli strzykawka jest szczelna to ciśnienie w jej wnętrzu obniży się na tyle, że woda zacznie wrzeć w temperaturze pokojowej, czego objawem są pojawiające się w całej objętości pęcherzyki pary wodnej.
Z odpowiedniego równania Clapeyrona znając temperaturę wody możemy wyliczyć jak bardzo obniżyło się ciśnienie wewnątrz strzykawki.
Życzę miłej i pouczającej zabawy:)
Literatura dodatkowa:
- Atkins P.W., Chemia fizyczna, Wydawnictwo Naukowe PWN, Warszawa, 2001
- Basiński A., Bielański A., Gumiński K., Chemia fizyczna. Wyd. 3, Państwowe Wydawnictwo Naukowe, Warszawa, 1966, str. 297
- West J. B., Barometric pressures on Mt. Everest: New data and physiological significance, Journal of Applied Physiology, 1999, 86(3), str. 1062–1066
Marek Ples